MDCC Insight
home 알림마당 MDCC Insight
[움트 CRO 양석원 본부장] 신의료기술을 적용한 디지털 의료기기의 기술 개발 및 임상 수립 전략
| 작성자 | 정태영 | ||
|---|---|---|---|
| 작성일 | 2026-01-08 | 조회수 | 503 |
전주기 관점의 개발 전략 필요성, 임상시험의 성패를 좌우하는 5가지 실무 포인트
움트 CRO
양석원 본부장

의료기기 임상시험 현장에서 발생하는 문제의 대부분이 ▲기술문서 ▲사용적합성 ▲소프트웨어 버전 관리 ▲데이터 보안 및 개인정보보호 ▲GMP 연계성 부족에서 비롯된다는 점을 체감하고 있다.
기술문서와 임상시험계획서의 불일치, 소프트웨어 버전 변경으로 인한 IRB 재심의, 개인정보보호 미흡으로 인한 기관의 임상시험 미승인 등이 대표적이다.
이와 같은 모든 문제는 개발 초기에 조금만 준비했더라면 충분히 예방할 수 있었던 사안들이다.
이 다섯 가지 핵심 사항이 실제 임상시험 단계에서 어떤 영향을 미치는지, PM으로서 겪었던 실무 사례(단 여기서 실무 사례는 본인이 실제 경험한 사례와 유사한 사례)를 중심으로 기술하고자 한다.
들어가며: 처음부터 끝을 설계하는 전주기 관점의 개발 전략 필요성
최근 디지털 헬스케어 시장이 빠르게 성장하면서 많은 스타트업과 벤처기업들이 혁신적인 디지털 의료기기를 개발하고 있다.
그러나 뛰어난 기술력을 가졌더라도 임상시험 단계에서 예상치 못한 장벽에 부딪히는 경우가 많은데 특히 인력과 자원이 제한된 스타트업의 경우, 기술 개발에만 집중하다 보면 임상시험을 위한 필수 준비사항을 놓치기 쉬워서 실제 임상시험 단계에 들어가게 되면 여러 난관에 봉착하는 경우가 많은 것이 현실이다.
이는 개발 로드맵에 치명적인 차질을 빚어, 결국 상용화라는 최종 관문 앞에서 '죽음의 계곡(Death Valley)'을 넘지 못하는 안타까운 결과로 이어지곤 한다.
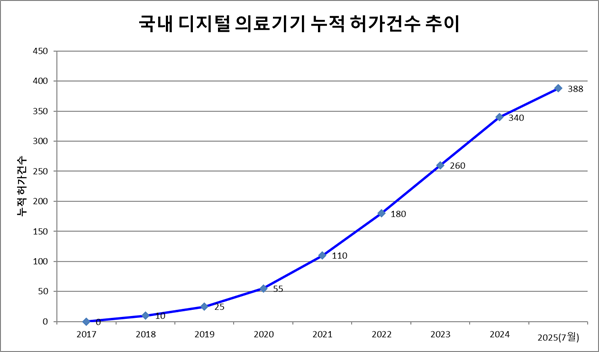
그림 1: 식품의약품안전처(2025.7월 기준)
위 그래프에서 보듯 시장은 폭발적으로 성장하고 있지만, 그 이면에는 임상시험 단계에서 좌절을 겪는 수많은 기업이 있다.
본 기고문은 현장에서 발로 뛰는 임상 PM의 시각에서, 디지털 의료기기 개발 실무진들이 간과하기 쉬운 5가지 핵심 요소가 실제 임상시험 현장에서 어떤 '나비효과'를 불러오는지 구체적인 사례를 통해 짚어보고자 한다. 이를 통해 개발 초기부터 임상시험과 인허가를 염두에 둔 '역설계(Reverse Engineering)' 전략을 수립하여 개발 기간을 단축하고 성공 확률을 높이는 데 실질적인 도움을 드리고자 한다.
이때 디지털 의료기기에 대한 제품 코드와 등급 판단은 기본적으로 자율적인 판단을 권고하나, 필요 시 사전검토 또는 식약처 방문상담 등을 통해 사전에 검토 또는 자문을 받는 것을 권장한다.
본론: 임상시험의 성패를 좌우하는 5가지 실무 포인트
본인은 임상시험 전문가이지, 의료기기 개발의 모든 단계에 대한 지식과 경험을 갖은 기술 전문가는 아니다.
다만 의료기기 임상시험 현장에서 발생하는 문제의 대부분이 ▲기술문서 ▲사용적합성 ▲소프트웨어 버전 관리 ▲데이터 보안 및 개인정보보호 ▲GMP 연계성 부족에서 비롯된다는 점을 체감하고 있다.
기술문서와 임상시험계획서의 불일치, 소프트웨어 버전 변경으로 인한 IRB 재심의, 개인정보보호 미흡으로 인한 기관의 임상시험 미승인 등이 대표적이다.
이와 같은 모든 문제는 개발 초기에 조금만 준비했더라면 충분히 예방할 수 있었던 사안들이다. 본론에서는 이 다섯 가지 핵심 사항이 실제 임상시험 단계에서 어떤 영향을 미치는지, PM으로서 겪었던 실무 사례(단 여기서 실무 사례는 본인이 실제 경험한 사례와 유사한 사례)를 중심으로 기술하고자 한다.
1. 기술문서: 책상 위 서류가 아닌, 임상시험의 설계도
많은 개발팀이 기술문서를 허가 신청을 위한 '후속 서류 작업'으로 생각하지만, 임상시험 PM에게 기술문서는 임상시험계획서(Protocol)의 근간이 되는 '설계도'이다.
기술문서의 '사용 목적'과 임상시험계획서의 '연구 목적'은 토씨 하나 다르지 않게 일치시켜야 한다.
임상시험계획서는 이 기술문서를 기반으로 작성되므로, 둘 중 하나라도 변경되면 일정에 차질이 발생하고 이는 임상시험 초기 단계의 가장 흔한 지연 사유가 된다. 특히 식약처 허가임상의 경우 더 많은 연구기간 지연을 초래한다.
사용 목적(Intended Use)을 명확히 해야 한다. 즉 '누가, 어떤 질병을, 어떻게 진단/치료/예방하기 위해 사용하는가?'를 한 문장으로 정의해야 한다. 이 문장은 의료기기 등급, 임상시험 필요 여부, 허가 경로를 결정하는 첫 단추다.
실제사례로 A사의 AI 기반 폐질환 진단 보조 소프트웨어 개발 사례를 보자. 기술문서에는 "흉부 X선 영상에서 폐렴 의심 소견을 검출하여 의료진의 판독을 보조"로 기재되었으나, 임상시험계획서에는 "폐렴을 진단"이라고 표현되어 IRB(임상윤리위원회) 심사 단계에서 문제가 발생했다. '보조'와 '진단'의 차이는 의료기기 등급을 2등급에서 3등급으로 상향시키는 결정적 요인이었고, 결국 임상시험계획서 전면 수정과 함께 통계적 검정력 재계산, 대조군 설정 변경 등으로 임상시험 착수가 6개월 지연되었다. 더욱이 3등급으로 상향되면서 필요한 임상시험 대상자 수가 120명에서 240명으로 증가하여 예산이 2배 이상 소요되는 결과를 초래했다.
2. 사용적합성 테스트: 형성평가 → 설계 개선 → 총괄평가의 단계적 접근이 필수
사용적합성(Usability)은 단순히 '앱을 예쁘고 편하게 만들기 위한 단순한 UI/UX 테스트가 아닌, 환자 안전을 위한 핵심적인 안전성 검증이다.
임상 현장에서 사용적합성은 환자의 순응도(Compliance)와 직결되며, 나아가 데이터의 신뢰성을 결정짓는 핵심 변수다. 실제 IRB(임상윤리위원회) 심사 단계에서 사용적합성 테스트 결과는 제품 안전성, 환자 위험성 평가의 근거자료로 매우 중요하게 취급되고 있다.
예를 들어 환자가 직접 사용하는 DTx(디지털 치료제)의 경우, 사용적합성 테스트 미흡 때문에 IRB 승인이 보류되는 케이스를 경험하곤 한다. 현장 실무에서 자주 접하는 문제로 1) 앱 버튼이 헷갈려서 잘못 입력한 경우, 2) 안내 문구를 읽지 못해 과제를 건너뛰어 데이터 누락, 3) 설정 메뉴에 들어가는 방법을 헷갈려서 중도 탈락하는 경우가 일반적인 케이스다.
임상시험 PM 입장에서 가장 우려되는 상황은 이와 같은 사용성의 낮은 순응도로 인해 유효성 평가에 실패하는 것이다. 경도인지장애 치료기기 '코그테라'의 성공 사례는 개발 초기부터 고령층을 대상으로 한 철저한 형성평가(버튼 조작 없이 음성 명령만으로 훈련을 수행할 수 있는 고령자 친화적 인터페이스 구축)를 통해 사용적합성을 개선한 것이 높은 임상시험 순응도로 이어진 점을 꼽을 수 있다. 사용적합성 평가는 비용의 이슈가 아니라, 임상시험 실패 리스크를 줄이는 가장 효과적인 투자다.
반면 반대의 사례도 주목할 필요가 있다. 사용적합성 평가를 임상시험 직전에 형식적으로만 진행한 경우로 임상시험 시작 후 2주차부터 문제가 드러나기 시작했다. 환자들이 매일 수면 일지를 작성해야 하는데, 앱의 날짜 선택 UI가 직관적이지 않아 전날 데이터를 오늘 날짜에 입력하는 오류가 빈번했다. 또한 "오늘 잠들기까지 걸린 시간"을 입력하는 항목에서 '분' 단위 입력창이 너무 작아 50대 이상 참여자의 35%가 잘못된 값을 입력했다.
3. 소프트웨어 버전 변경: 데이터 무결성을 확보하라
디지털 의료기기는 개발 중 지속적으로 SW 버전이 변경되는 경우가 발생한다.
실무에서 자주 발생하는 관련 사례는 1)병원마다 다른 버전 설치 2)업데이트 이력 부재로 어떤 데이터가 어떤 버전에서 수집되었는지 추적 불가 3)임상 중 기능 개선을 반영했다가 IRB 변경승인 누락으로 프로토콜 위반 4)OS 업데이트로 기기 일부 기능 작동 불가 발생 등이다. 이러한 경우 가장 자주 발생하는 문제는 ‘임상시험 도중 버전 변경 시, IRB와 식약처에 이를 어떻게 보고하는가?’이다.
실제 현장에서는 Semantic Versioning(Major.Minor.Patch)를 활용해 관리하고, Major/Minor 변경 시엔 식약처 변경승인 후 IRB 신규/보완 심사가 필수적이다. Minor/Patch 변경은 임상현장에서 관리 이력만 남기는 경우가 많으나, 논란의 소지가 있으므로 변경통제위원회(Change Control Board, CCB)를 통한 공식적인 의사결정 기록이 요구된다. 즉, 안전성/유효성에 영향을 미치는 업데이트라면 식약처 변경승인 후 IRB 심의가 필수이며, 단순 버그 수정이라도 내부 타당성 입증 문서(V&V) 구비 후 IRB 보고는 반드시 수행하는 것을 권장한다.
임상시험 진행 시 실무적인 작은 팁은 EDC(전자증례기록)에 소프트웨어 버전을 자동 입력되도록 설계하는 것이 좋다. 왜냐하면 수동 입력은 누락되는 경우가 많기 때문이다. Minor한 케이스는 위반보고로 끝낼 수 있지만, Major한 케이스의 경우 임상데이터가 무효화돼서 많은 시간과 비용을 투자한 임상시험이 실패로 끝날 수 있다.
4. 데이터 보안 및 개인정보보호: 동의서 한 장의 무게
디지털 헬스케어 임상시험에서 IRB 심사가 가장 까다로운 부분이 바로 '개인정보보호'다.
특히 서버 보안과 데이터의 2차 활용 문제는 미리 준비하지 않으면 임상 종료 후에도 발목을 잡을 수 있다. 데이터 보안과 개인정보보호는 단순한 기술적 요구사항이 아닌, IRB 승인과 임상시험 착수의 결정적 조건임을 간과하지 말아야 한다.
현장에서 자주 발생하는 케이스의 예시로는 1)클라우드 서버가 해외 리전에 있어 IRB에서 반려 2)DICOM 헤더에 병원 정보가 남아 있어 재식별 가능성 지적 3)데이터 전송 암호화 방식 설명 부족 4) 임상시험 참여 대상자 동의서(Informed Consent Form)에 AI 재학습 활용 문구가 빠져 있어 임상데이터 재사용 불가 등이 있다.
따라서 실무적으로 임상시험 참여 대상자 동의서(ICF)에 "본 임상시험에서 수집된 영상 및 데이터는 비식별 처리 후 인공지능 알고리즘 성능 개선을 위한 학습에 활용될 수 있습니다. 단, 개인을 식별할 수 있는 정보는 완전히 삭제됩니다." 라는 문구를 포함시키는 걸 권장한다.
5. 향후 인허가(GMP) 준비: 임상시험은 GMP의 연장선
임상시험 결과가 품목허가 및 GMP(QMS) 심사 과정까지 이어진다는 점을 간과하는 기업이 많다.
임상에서 확보한 Clinical Evidence와 실제 제품의 Configuration, Risk Management 문서가 불일치하면, GMP 심사에서 추가 보완 요청을 받을 수 있다. 임상시험 중 발생한 문제는 최종적으로 모두 허가 문서의 근거가 된다. 따라서 임상시험 데이터를 단순히 “연구결과”로 보지 말고 GMP 문서의 일부로 인식해야 한다.
임상시험 단계에서 GMP심사를 위해 병행으로 준비해야 하는 관리 포인트는 1)임상에 투입되는 기기는 최소한 GMP 적합 환경과 동등해야 한다. 예로 임상시험은 개발자 PC 환경에서 진행되었는데, 상용화 제품은 클라우드 서버 기반인 경우 두 환경이 동등하다는 검증 자료를 제출할 것을 요청받을 사례를 들 수 있다. 2)임상 중 변경사항은 관리대장에 기록해야 한다. 3)임상 중 발견된 사용오류, 버그는 CAPA 보고서 등으로 근거문서를 남겨 놓아야 한다.
마무리: 임상시험 단계에서 연구 지연은 곧 돈이다.
지금까지 살펴본 5가지 핵심 사항은 결국 "기술 개발 후 규제 대응"이 아닌 "규제를 고려한 기술 개발"이라는 하나의 메시지로 귀결된다.
디지털 의료기기 개발은 더 이상 기술팀만의 영역이 아니며, 개발 초기부터 임상, 규제, 품질 담당자가 하나의 팀으로 움직이는 통합적 접근을 권장한다.
- 기술문서는 임상시험계획서와 동기화된 '살아있는 설계도이다.
- 사용적합성 평가는 비용이 아니라 데이터 품질과 직결되는 '안전성 검증'의 핵심이다.
- 버전 관리는 추적 불가능한 데이터가 되지 않도록 막는 '데이터 신뢰성의 보루'다.
- 개인정보보호는 '추후 AI 학습 활용'과 같은 미래 가치를 위해 미리 확보해야 할 '동의'에서 시작된다.
- GMP는 임상시험 단계부터 준비해야 할 '품질 보증'의 기본이다.
또한 자원과 경험이 부족한 스타트업과 벤처기업에게 이 모든 것을 완벽히 수행하는 것은 어려운 과제일 수 있다.
특히 허가임상의 경우 상기 5가지의 이슈로 인한 연구지연은 연구진의 관심도 저하에 따른 모집지연 → 연구기간 증가 → 비용증가로 이어지는 악순환의 고리에 빠져들게 된다.
'밑 빠진 독에 물 붓는 격'인 임상시험을 성공적으로 마무리하기 위해서는 상기 5가지 사항을 개발 초기부터 철저히 준비하는 것이 무엇보다도 필요 할 것이다.
- 이전글 [블루포인트파트너스 박수용 팀장] 투자 패러다임 변화에 따른 초기 의료기기 기업의 투자 유치 전략 및 향후 과제
- 다음글 [분당서울대병원 김건영 교수] 중재의료기기의 개발의 길은 어디에 있는가























