산업통상자원부
home 자료실 유관기관 자료 산업통상자원부
브라질, 'MDSAP' 따면 빨라지는 'ANVISA' 인증
| 작성자 | 관리자 | 카테고리 | 대한무역투자진흥공사 |
|---|---|---|---|
| 등록일 | 2018-05-17 | 조회수 | 6,459 |
| 출처 | KOTRA | ||
| 원문링크 | http://news.kotra.or.kr/user/globalBbs/kotranews/5/globalBbsDataView.do?setIdx=244&dataIdx=166184 | ||
※원문 확인 및 문의를 원하시면 아래를 클릭해주시기 바랍니다.
해당홈페이지 바로가기
- ANVISA 인증은 관료주의적 행정으로 인해 취득절차가 매우 까다로워 -
- MDSAP 인증으로 ANVISA GMP 심사 대체, 시간과 비용 모두 절약 -
□ 개요
ㅇ ANVISA 인증은 관료주의적 행정으로 인해 취득절차가 매우 까다로워, 브라질 의료기기 시장 진출을 희망하는 국내 및 외국 기업에게 장벽으로 작용하고 있음.
- MDSAP 인증 제도를 통해 GMP 심사를 해외에서 받을 수 있어 ANVISA 인증 과정이 간소화될 전망임.
□ ANVISA 허가
ㅇ의료장비, 의약품, 보건제품, 화장품 등과 같은 품목의 경우 ANVISA(위생감시국) 인증을 취득하지 않을 경우, 브라질 시장 내 판매 및 유통이 불가함.
- 그러나 인증 취득 절차가 까다롭고 시간과 비용이 많이 소요되기 때문에 외국기업들이 브라질 시장에 진입하는데 있어서 장벽으로 작용하고 있음.

ㅇ 특히 GMP(공장실사) 심사는 의약품이나 의료기기, 화장품 업체가 ANVISA를 취득하는 과정에서 필수적으로 거쳐야 되는 단계인데, 신청업체에 비해 ANVISA 검사관이 턱없이 부족하여 어려움을 겪고 있는 것으로 드러남.
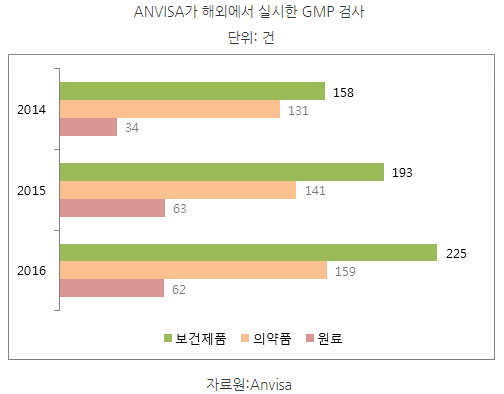
- ANVISA 에 따르면, 2016년 제약업체의 GMP 신청건수는 952건으로 이중 285건이 국내신청이고 나머지 667건은 해외 신청으로 밝혀짐.
- 2014~2016년 사이 ANVISA가 해외에서 실시한 GMP 심사 건수는 323건에서 446건으로 38% 증가한 것으로 나타남.
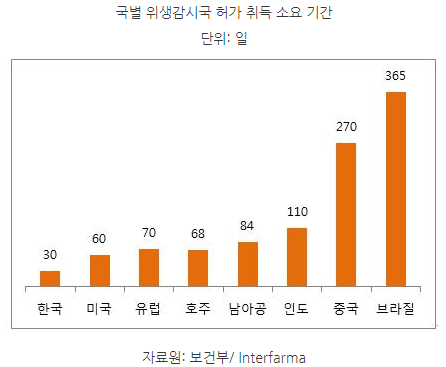
ㅇ의약품의 경우, ANVISA 허가 취득에 소요되는 시간은 평균 365일로 한국(30일)이나 미국(60일)과 많은 차이를 보이는 것으로 나타남.
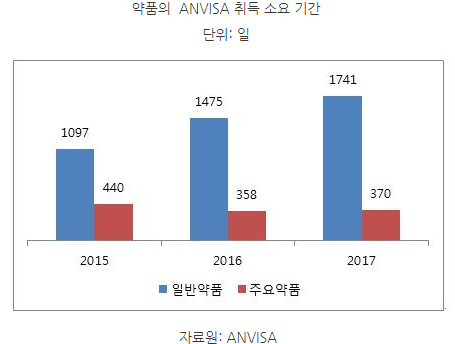
ㅇ2017년의 경우, 제네릭 약품이나 시밀러 약품이 ANVISA 허가를 취득하는데 무려 1741일(4년 10개월)이 걸린 것으로 밝혀졌는데, 이 같은 지연의 주 원인은 성분 테스트 등 제품 분석 과정에서 지나치게 많은 시간이 걸렸기 때문으로 나타남.
- 브라질 정부는 이같은 애로사항을 해소하기위해 일반 약품은 365일, 신속한 시장 출시가 필요한 약품은 120일, 응급 수요 약품은 90일 등 분석 기간에 대한 최대 한도를 규정함,
ㅇ2016년의 경우, GMP 심사를 받기 위해 평균 소요된 기간은 52개월로 나타났으며, 심사 지연의 주원인은 검사 수요 대비 전문 인력의 대거 부족인 것으로 드러남.
- ANVISA 는 2019년까지 심사기간을 24개월 이내로 단축한다는 목표를 세웠으며 검사에 투입되는 전문 인력 수도 대폭 늘릴 예정인것으로 나타남.
- ANVISA는 2016년 11월 GMP 심사 효율 제고 방안으로 지리적으로 가까운 지역의 GMP 심사를 한꺼번에 몰아서 실시하는 파일롯 프로젝트를 성공리에 실시함.
□ MDSAP 인증 제도
ㅇ 2013년 ANVISA 는 법령 RDC nº39/2013를 통해 “ANVISA가 인정한 외부 기관에서 GMP 심사를 받아도 효력을 인정받을 수 있다” 라고 발표함.
- 동 법령에 근거하여, ANVISA는 의료기기 품질 단일 심사 프로그램인 MDSAP(Medical Device Single Audit Program)을 도입하였으며 MDSAP를 통해 이미 해외에서 GMP를 실시한 업체는 ANVIS 주도의 별도 GMP 심사가 필요 없게 됨.
- ANVISA에 따르면, MDSAP 제도 도입 이후, GMP 심사 합격 건수가 2015년 1건에서 201년 25건으로 대폭 늘어난 것으로 밝혀짐
- MDSAP는 현재 오스트레일리아, 브라질, 캐나다, 일본, 미국 등 5개국에서 운영되고 있으며 각 국가의 위생관리국이 허가한 인증대행기관을 통해 GMP 심사를 해외에서 받을 수 있음.
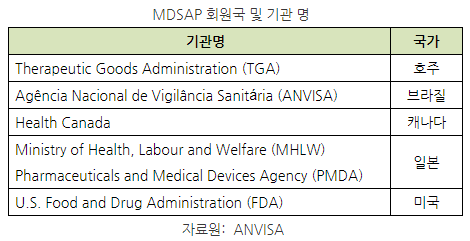
ㅇ 회원국이 아닌 국가에서도 TUV 등을 통해 MDSAP를 받을 수 있으나, 단, ANVISA가 공식 인정한 MDSAP 대행 업체를 통해 받아야 유효함.
- 일례로 TUV의 경우, 전 세계 다양한 지역에 사무실을 보유하고 있으나 ANVISA가 MDSAP 인증 대행 업체로 공식 허가한 사무실을 통해 취득한 MDSAP라야만 인정받을 수 있음.
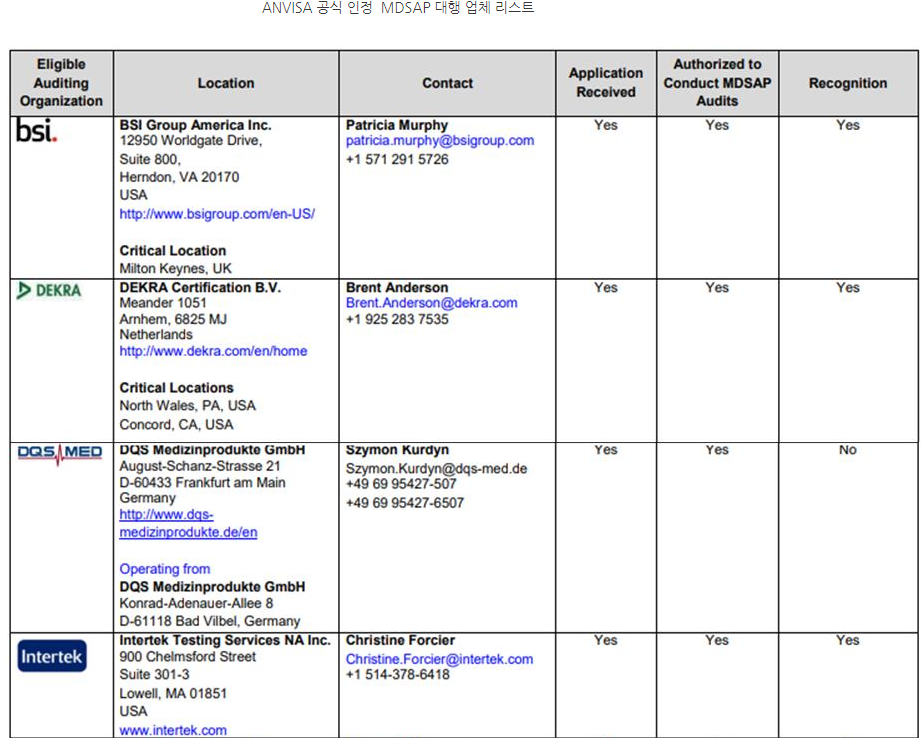
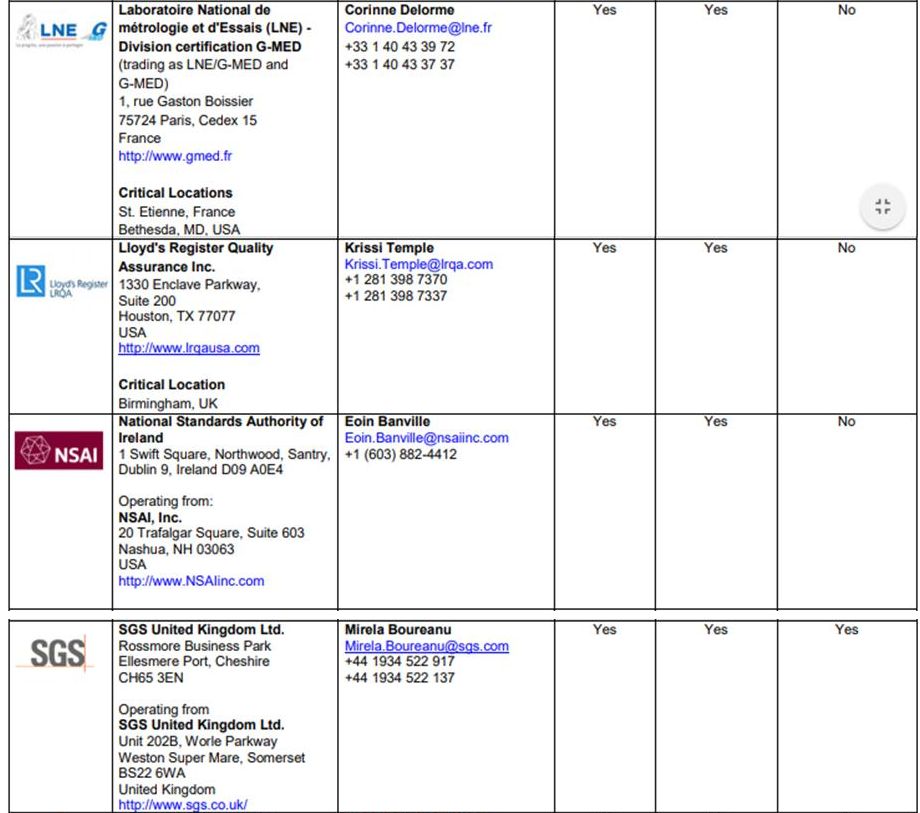
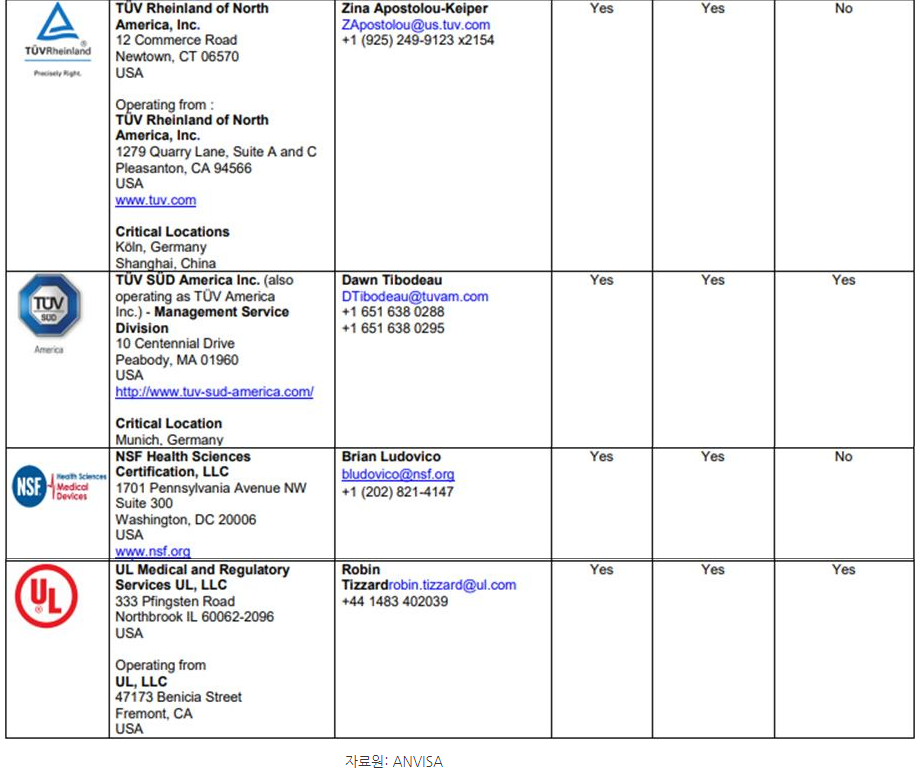
ㅇ MDSAP 인증 취득 절차 관련 전문가 코멘트
- MDSAP 인증 대행업체 TUV 컨설턴트에 따르면, 브라질 시장 진출을 희망하는 보건, 의료기기 기업의 경우, MDSAP가 인정하는 검사 기관과 직접 접촉하여 GMP 심사 가능 여부 및 ANVISA 인정 여부 등을 확인한 후, 심사를 받는 절차를 시작해야 함.
- 또한 MDSAP가 인정한 기관을 통해 인증을 취득하는 경우, ANVISA가 해당기관에게 공식인증기관으로 활동할 수 있도록 부여한 허가 기간을 반드시 확인해야 함.
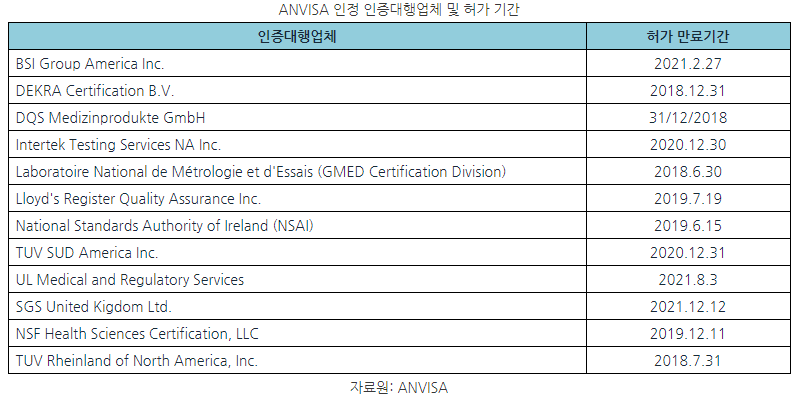
□ 시사점
ㅇMDSAP 인증은 ANVISA가 요구하는 복잡한 GMP 심사를 대체할 수 있고 시간과 비용을 모두 절약할 수 있어 기업들로부터 높은 호응을 얻고 있음.
- MDSAP 인증대행업체들은 모두 동일한 방법과 절차를 통해 GMP 심사를 하기 때문에, 업체들은 가까운 지역에 위치한 인증업체를 골라 심사를 받을 수 있다는 것이 최대 장점임 .
ㅇANVISA는 2018년 내에 14개 신규 MDSAP 인증대행업체를 선발할 계획이어서, 브라질 시장 진출을 희망하는 한국 의료기기 업체들은 MDSAP를 활용하여 ANVISA 취득 절차를 간소화하는 방안을 고려해 볼 필요가 있음.
자료원: ANVISA 홈페이지, 경제지 Valor Economico, 무역관 보유 자료 종합























