국내뉴스
home > 국내외뉴스> 국내뉴스
- 글자크기
로제타엑소좀, ‘박테리아 엑소좀’ 면역항암제 개발전략
| 작성자 | 관리자 | ||
|---|---|---|---|
| 작성일 | 2022-10-05 | 조회수 | 140 |
| 출처 | 바이오스펙테이터 | ||
| 원문 | http://www.biospectator.com/view/news_view.php?varAtcId=17263 | ||
대량배양·생산 용이 약독화 박테리아 엑소좀 'REX101'..종양 마우스모델서 면역반응↑+항암효과, 내년 임상진입 목표..엑소좀 기반 'GNV 플랫폼', 안전성 높고+고분자약물 전달 가능
로제타엑소좀(Rosetta Exosome)이 약독화 박테리아로부터 얻은 엑소좀(exosome)을 이용한 면역항암제 및 약물전달체(DDS) 개발에 나섰다. 박테리아 기반 엑소좀은 대량배양·생산이 용이하고, 크기가 큰 치료물질도 탑재가 가능하다는 점에서 기존 줄기세포 기반 엑소좀과 차별화된다.
고용송 로제타엑소좀 대표이자 포항공대 교수는 “약독화 박테리아를 이용하면 줄기세포보다 대량배양이 용이할 뿐 아니라, 일정한 품질을 가진 엑소좀을 높은 수율로 대량생산할 수 있다는 것이 차별화된 부분”이라며 “면역시스템을 활성화하는 REX 플랫폼과 단백질 등 크기가 큰 치료물질의 전달이 가능한 GNV 플랫폼을 기반으로 면역항암제를 개발하고 있다”고 말했다.
로제타엑소좀은 지난 2016년 고용송 포항공대 교수가 설립했다. 현재 각자대표를 맡고 있는 박선주 대표는 이전에 에스포, 실리콘바인에서 CEO를 역임했다. 최고과학책임자(CSO)로는 아모레퍼시픽에서 연구소장을 역임한 이태룡 박사가 맡고 있다. 로제타엑소좀은 지난 2020년 pre시리즈A로 23억7500만원, 지난해 시리즈A로 80억원을 유치했다.
로제타는 현재 박테리아 기반 엑소좀을 이용한 ‘REX 플랫폼’으로 면역항암제, 면역증강제 등을 개발하고 있으며, 크기가 큰 치료물질을 탑재해 전달하는 GNV 플랫폼을 약물전달기술(DDS)로 보유하고 있다. 로제타의 리드 파이프라인은 REX 플랫폼 기반의 ‘REX101’으로 마우스 모델에서 항암효과를 확인했다. 로제타는 내년 1분기 REX101의 임상시험계획(IND)를 제출하는 것이 목표다.
약독화 박테리아 엑소좀 “대량생산·정제 용이 측면서 차별화”
엑소좀이란 세포에서 유래된 50-200nm의 세포외 소포체(extracellular vesicles, EVs)의 일종이다. 엑소좀은 단백질, 지질, 핵산 등 다양한 생체 활성물질들을 포함하고 세포간 정보교환을 위한 메신저 역할을 한다.
줄기세포 유래 엑소좀은 자체적으로도 재생효과가 있는 물질을 함유하고 있어 치료제로 연구가 진행되고 있으며, 엑소좀에는 화학항암제, 핵산치료제(DNA, RNA 등), 펩타이드 등을 탑재해 기존에 타깃하기 어려웠던(undruggable) 부위로 약물을 전달하는 약물전달체(DDS)로도 사용된다.
고 대표는 “엑소좀 분야의 주요 이슈 중 하나인 대량생산은 엑소좀의 정제보다는 줄기세포의 대량배양에 대한 한계에 대한 문제로 판단하고 있다”며 “이 부분에서 박테리아는 손쉽게 대량배양이 가능하므로 엑소좀의 대량생산과 정제에서 강점을 가진다”고 말했다.
엑소좀은 크게 줄기세포에서 자연적으로 분비되는 것과 인공적으로 엔지니어링해 만드는 것으로구분할 수 있다. 자연적으로 분비되는 것은 특정 세포의 배양액에서 정제하는 방식으로 대량의 엑소좀을 얻기 위해서는 결국 대량으로 배양해야 하는 한계가 있다.
엔지니어링 방식은 엑소좀 모사체(mimetic), 박테리아 엑소좀 등이 있으며 배양·정제하거나 짜내는 방식으로 생산할 수 있다. 로제타엑소좀이 구축한 박테리아 엑소좀 생산법은 500L 배양기를 1개월간 운용해 100만도즈를 생산할 수 있을 만큼 대량배양 및 생산이 용이하다는 점에서 기존 줄기세포 엑소좀과 차별화된다.
이런 박테리아 엑소좀을 이용한 첫 승인 약물로는 지난 2012년과 2015년 각각 유럽의약품청(EMA)과 미국 식품의약국(FDA)에서 승인된 GSK의 뇌수막염 예방백신 ‘벡세로(Bexsero)’가 있다. 벡세로의 지난해 매출은 8억2000만달러였다.
리드 파이프라인 ‘REX101’, ”마우스 모델서 항암효과 및 PD-1 항체와 시너지”
먼저 로제타엑소좀은 대장균(E. coli)으로부터 얻은 엑소좀을 대장암세포(CT26)을 피하에 주입한 마우스 모델에 투여해 항암효과를 확인했다(doi: 10.1038/s41467-017-00729-8). 구체적으로 연구팀은 대장균의 외막을 이용한 베지클(outer membrane vesicle, OMV)을 엔지니어링해 지질다당류(lipopolysaccharide) 구성요소인 msbB(lipod A acyltransferase)를 비활성한 형태인 ‘ΔmsbB OMV’를 만들었다. 지질다당류를 비활성화 하면 TLR4와 같은 면역반응 유도 수용체를 자극하지 않아 IL-8 등 면역 사이토카인의 형성을 억제한다.
연구팀은 대장암 마우스모델에 ΔmsbB OMV를 투여한 결과 암세포가 사라지는(completely eliminated) 것을 확인했다. 또 연구팀은 ΔmsbB OMV를 마지막으로 투여하고 4주가 지난 시점에 종양세포를 마우스 모델에 재주입한 결과 암세포가 성장하지 않은 것을 확인했다. 연구팀은 여기에 더해 2번째 주입 후 3주가 지난 시점에 종양세포를 3번째로 재주입해도 항암효과가 유지되는 것을 확인했다. 이는 면역세포가 특정 암세포를 기억해 종양성장을 억제한다는 의미다.
이런 결과를 기반으로 로제타엑소좀은 면역시스템을 활성화하는 REX 플랫폼 구축했으며, 이를 적용한 리드파이프라인 ‘REX101’를 현재 전임상 단계에서 연구하고 있다. REX101은 선천면역시스템을 자극해 T세포를 활성화하고 종양세포에 침윤(infiltration)을 증가시킴과 동시에 암세포에 대한 후천면역시스템(adaptive immunity)을 유도해 항암효과를 나타내는 기전이다.
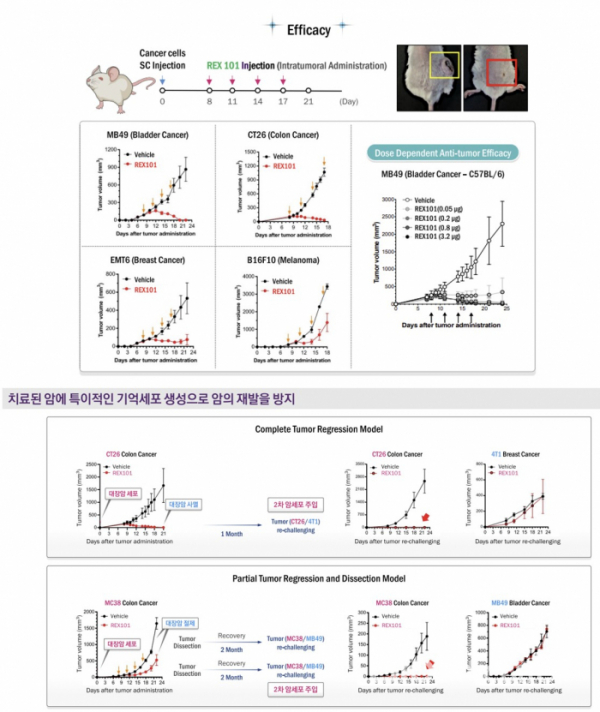
REX101의 항암효과를 확인하기 위해 로제타엑소좀은 전립선암(MB49), 유방암(EMT6), 대장암(CT26), 흑색종(B16F10) 세포주를 피하투여한 마우스모델을 만들었다. 로제타엑소좀은 이들 마우스 모델에 REX101을 8, 11, 14, 17일차에 종양내 투여(intratumoral injection)했다. 이후 24일시점에 REX101을 투여한 전립선암, 유방암, 대장암 마우스모델은 종양세포의 크기가 약 100~150㎣에서 0~100㎣ 수준으로 감소하며 항암효과를 나타냈다. 반면 위약군은 600~1200㎣으로 암세포가 성장했다.
로제타엑소좀은 랫(rat)과 도그(dog) 모델에 항암효과를 나타낸 REX101의 용량보다 100배이상을 투여해도 심각한 독성을 나타내지 않은 GLP 독성연구를 통해 안전성도 확인했다.
다음으로 로제타엑소좀은 REX101을 투여해 항암효과를 확인한 종양 마우스 모델에 다시 암세포를 투여시 항암효과가 유지되는 것을 확인해 전이와 재발을 효과적으로 억제할 것으로 기대하고 있다.
구체적으로 로제타엑소좀은 완전관해(CR)와 부분반응(PR)을 보인 대장암 마우스모델(CT26, MC38)에 다시 종양세포를 주입해 항암효과를 확인하는 챌린지(re-challenge) 연구를 진행했다. 먼저 로제타엑소좀은 대장암 마우스모델(CT26)에 REX101을 투여 후 CR을 확인하고 1달 후 대장암 세포 CT26과 유방암 세포 T41를 함께 투여했다. 암세포를 재투여하고 21일시점에 REX101으로 치료받았던 마우스모델은 대장암세포가 성장하지 못한 반면, 유방암세포는 자라나는 결과를 보였다.
이런 결과는 PR을 보인 마우스모델에서도 일관되게 나타났다. 로제타엑소좀은 REX101 투여 후 PR을 보인 마우스 모델에서 암세포를 제거하고 2달뒤, 대장암세포 MC38와 전립선암세포 MB49를 함께 투여한 결과, REX101을 투여했던 마우스 모델에서는 대장암세포가 자라지 못했으나 전립선암세포에서는 항암효과가 없었다.
로제타엑소좀은 이외에도 REX101과 PD-1 항체를 병용투여한 경우 REX101 단독투여군 보다 항암효과와 종양에 대한 T세포침윤(infiltration) 증가한 시너지효과를 확인했다.
고 대표는 “REX101을 종양내투여한 종양세포(primary tumor) 뿐만 원격발생한 종양(distal tumor)에서도 항암효과를 확인했으며, 암세포 재투여시에도 종양성장을 억제했다”며 “원발성 종양에 대한 항암효과 뿐만 아니라 기억면역을 자극해 암의 재발과 전이를 억제하는데도 효과가 있을 것으로 기대하고 있다”고 말했다.
Ghost Nano Vesicle(GNV) 플랫폼, “고분자약물 탑재 가능, 안전성 높여”
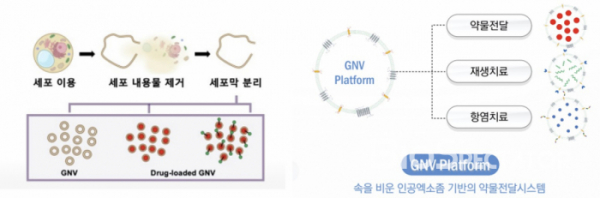
로제타엑소좀은 고분자 치료물질도 탑재가 가능하면서도 안전성을 높인 약물전달시스템(DDS)로 GNV 플랫폼을 개발했다. GNV 플랫폼은 pH를 조절해 엑소좀을 터뜨려 내부의 물질들을 모두 제거하고 다시 베지클을 만드는 기술로, 베지클을 만드는 과정에서 치료물질을 탑재할 수 있다.
특히 GNV 플랫폼은 엑소좀 내부의 불필요한 내용물을 비워 안전성이 높고, 다양한 특성과 크기의 약물을 탑재가능하다는 설명이다. 이는 기존에 관을 통해 짜내는 방식의 엑소좀 모사체가 엑소좀 내부에 치료물질과 함께 핵산, 단백질 등 여러물질이 포함돼 있어 생체 내에서 문제를 유발할 수 있는 한계를 가진 것과는 차별화되는 포인트다.
구체적으로 살펴보면 로제타엑소좀은 먼저 엑소좀에 알칼라인 솔루션(alkaline solution)을 처리해 세포막, 핵단백질, 핵산 등의 막시트(membrane sheets) 구성물을 얻었다. 이후 음파파쇄(sonication)와 원심분리를 거쳐 막성분(membrane pellets)을 얻고, pH 중성화(neutralization)을 거쳐 약물을 탑재하거나 탑재하지 않은 베지클을 얻는다(doi: 10.1002/adhm.201801082).
이태룡 로제타엑소좀 CSO는 “GNV 크기를 조정해 원하는 크기의 치료물질 대부분을 탑재할 수 있으며, 약 200nm 이하의 GNV를 기준으로는 200~300kDa 크기의 단백질, 모든 크기의 펩타이드, 3kbp의 유전자 등을 탑재 가능할 것”이라고 말했다.
이렇게 얻은 GNV에 탑재한 약물이 치료효과가 있을까? 연구팀은 대장균으로부터 얻은 OMV에 덱사메타손(dexamethasone)을 탑재한 ‘GNV-dexa’를 투여해 전신염증반응증후군(Systemic Inflammatory Response Syndrome, SIRS) 마우스 모델에서 항염증 효과를 확인했다.
연구팀은 대장균 유래 OMV를 정상형 마우스 모델에 2㎍, 5㎍, 10㎍, 20㎍, 40㎍ 용량으로 투여했다. 그 결과 OMV 20㎍, 40㎍ 용량에서는 투여 24시간 후부터 마우스의 생존률이 급격히 감소해 48시간 이후부터는 20% 미만이 생존했다. 연구팀은 20㎍ OMV과 함께 덱사메타손 0㎍, 5㎍, 10㎍, 20㎍, 40㎍이 탑재된 GNV-dexa를 투여한 결과 5㎍~40㎍ 용량의 GNV-dexa 투여군에서 80~100%의 생존률을 확인했다.
덱사메타손 단독투여군에서는 GNV-dexa보다 고용량을 투여해야 항염증 효과를 확인할 수 있었다. 연구팀은 OMV 20㎍을 투여한 마우스 모델에 GNV-dexa 10㎍과 덱사메타손 10㎍, 20㎍, 40㎍ 등을 투여했다. 그 결과 GNV-dexa 10㎍과 덱사메타손 40㎍ 투여군에서 100% 생존률을 보였다. 반면 덱사메타손 10㎍, 20㎍를 투여시에는 항염증 효과가 낮아 마우스모델의 생존률이 20~40%로 나타났다. 여기에 더해 GNV-dexa를 투여한 SIRS 마우스 모델은 체중 및 체온감소 등이 정상수준으로 회복됐다.
경쟁기업 코디악의 ‘ExoSTING’..고형암 1상서 “안전성 확인, 일부 환자서 항암효과”
엑소좀 분야의 글로벌 선두그룹으로 알려진 코디악 바이오사이언스가 진행하고 있는 엑소좀 기반 항암제의 임상결과를 살펴보자. 코디악은 ExoSTING의 고형암 임상 1상에서 약물용량에 따른 안전성을 확인하고 일부 환자군에서는 항암효과를 확인했다.
먼저 코디악의 ExoSTING은 STING(STimulator of INterferon Genes) 작용제(agonist)인 CDN을 탑재한 엑소좀 약물이다. ExoSTING은 엑소좀 특이적 단백질인 PTGFRN에 CDN을 탑재해 종양에 존재하는 APC(antigen producing cell)에 전달해 면역반응을 활성화하는 기전이다.
코디악은 두경부암, 연골모양육종(chondroidsarcoma), 대장암, 흑색종 등 고형암 환자 23명을 대상으로 ExoSTING 임상 1/2상(NCT04592484)을 진행했다. 임상에 참여한 환자들의 95%는 이전에 2번이상 치료받았으며, 65%는 면역관문억제제로 치료받았음에도 질병이 진행됐다. 임상에 참여한 환자들은 코호트1~5로 나뉘어 ExoSTING을 각각 0.3㎍(4명), 1㎍(3명), 3㎍(6명), 6㎍(7명), 12㎍(3명) 용량으로 종양내투여 받았다.
그 결과 ExoSTING을 0.3㎍~12㎍ 투여받은 환자(19명)는 STING 신호경로의 활성화를 보여주는 마커인 CXCL-10 mRNA 발현이 용량의존적으로 증가했다. 또 코디악은 0.3㎍~6㎍ 용량의 ExoSTING을 투여받은 환자(7명)에게서 PD-1 발현과 종양세포 내 T세포 침윤이 유의미하게 증가된 것을 확인했다. 또 자궁암, 연골모양육종, 피부암(cSCC) 등 일부 환자들에게서는 약물이 주입된 암세포 뿐만 아니라 다른 부위에 존재하는 암세포에도 항암효과를 보였다. 안전성 측면에서 코디악은 ExoSTING 투여시 3등급이상 부작용과 용량제한독성(dose limiting toxicity, DLT)를 확인하지 못했다.
코디악은 내년 1분기 ExoSTING의 임상 2상을 시작할 계획이다.