식품의약품안전처
home 알림마당 기관별 지원사업 식품의약품안전처
제한적 의료기술 평가 신청 안내
| 작성자 | 관리자 | 카테고리 | 신의료기술평가사업본부 |
|---|---|---|---|
| 등록일 | 2016-02-01 | 조회수 | 6,087 |
| 출처 | - | ||
| 원문링크 | - | ||
| 접수마감일 | |||
제한적 의료기술이란
‘안정성이 확보된 의료기술로서 대체기술이 없는 질환이거나 희귀질환의 치료·검사를 위하여 신속히 임상에 도입할 필요가 있어 보건복지부장관이 따로 정하여 고시하는 조건을 충족하는 경우에만 임상에서 사용 가능한 의료기술(「신의료기술평가에 관한 규칙」제3조제8항제2호)’로서 II-b등급 연구단계 의료기술 중 의료기관의 신청을 받아 신의료기술평가위원회의 심의를 거쳐 선정된 의료기관에서 비급여 진료를 허용하고 그 결과를 의과학적 근거로서 활용하는 제도입니다.
제한적 의료기술의 대상기술 및 신청자격
제한적 의료기술의 대상기술은 「의료법」 제53조에 의한 신의료기술평가를 거쳐 평가결과 제한적 의료기술의 조건을 충족하는 경우에 한하여 진행됩니다.
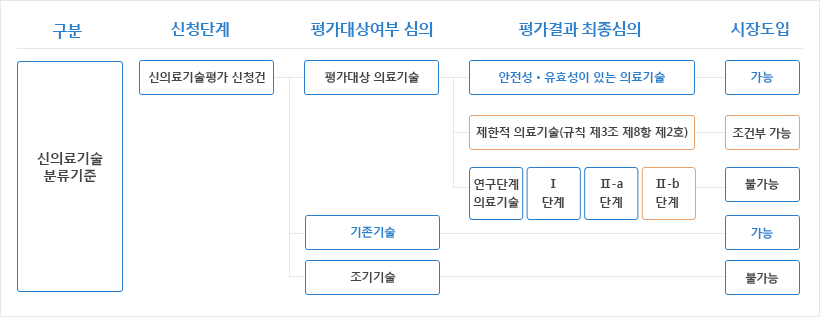
제한적 의료기술의 신청자격은 「의료법」 제3조에 의한 의료기관으로서 제한적 의료기술을 환자에게 수행할 수 있는 환경이 조성되어 있어야 합니다.
신청방법
제한적 의료기술 평가는 일반적인 신의료기술평가 신청과 달리 지정된 기간동안 사업공고를 통해 신청접수를 받고 있습니다. 사업공고는 보건복지부 홈페이지 및 한국보건의료연구원 홈페이지를 통해 공지되며, 제한적 의료기술 수행을 희망하시는 의료기관 소속 신청자께서는 신청접수 기간 동안 「신의료기술평가에 관한 규칙」 제3조 내지 별지에 의한 ‘신의료기술평가신청서’와 「제한적 의료기술 평가 및 실시에 관한 규정」 제3조 내지 별지에 의한 ‘제한적 의료기술 근거창출 계획서’ 및 관련 구비서류를 작성, 준비하여 한국보건의료연구원으로 제출하시면 됩니다.
1) 제출서류 및 방법
| 구분 | 제출서류 | 제출방법 |
| 신청서식 | ① 신의료기술평가 신청서 | 온라인 작성 (Step.1) |
| ② 제한적 의료기술 근거창출 계획서 | 온라인 작성 (Step.2-1) | |
| ③ 제한적 의료기술 근거창출 계획서 요약본 | 온라인 작성 (Step.2-2) | |
| ④ 제한적 의료기술 연구자 현황1) | ||
| 구비서류 | ⑤ 환자 증례기록서 양식 | 온라인 첨부 (Step.3) |
| ⑥ 「생명윤리 및 안전에 관한 법률」 제10조에 따른 기관윤리심의위원회 심의결과서2) 및 심의시 제출자료 일체 | ||
| ⑦ 실시책임의사 및 참여연구진의 연구 실적자료 | ||
| ⑧ 의료기기, 장비, 시설 현황 | ||
| ⑨ 내용을 증명할 수 있는 자료 | ||
| - [필수] 해당 신의료기술에 사용되는 의료기기(장비) 및 주요약품에 대한 식약처 허가증3) | ||
| - 근거창출계획서상 참고문헌, 부록, 기타자료 등 |
1) 다기관 연구의 경우, 모든 참여기관의 연구자 현황을 제출하여야 함
- 주 실시기관의 연구자 현황은 온라인 작성(Step.2-2)
- 참여기관의 연구자 현황은 “내용을 증명할 수 있는 자료”(Step.3) 에 첨부 요망
2) 신청·접수시 심의신청서로 갈음할 수 있으나 서면심의 전까지 심의결과서를 제출해야 함
- 다기관 연구의 경우, 참여기관의 기관윤리심의위원회 심의결과서를 모두 제출해야 함
3) 해당 의료기기(장비) 및 주요약품의 사용목적을 모두 확인할 수 있어야 함
2) 접수방법
- 온라인 신청(하단의 신청서 제출 버튼)
- 신청서식 항목별 작성 요령을 숙지한 후 작성 요망
3) 관련문의
- 신의료기술 평가사업2팀 선정평가 담당자(☎ 02) 2174-2774/2726)
4) 제출기간 : 2016년 2월 15일(월) 18:00까지
- 제출마감일 오후 6시까지 온라인 신청을 완료해야 함
- 온라인 신청 후 제출서류 검토 및 보완이 완료되어 접수번호가 생성되어야 접수가 완료됨
- 접수된 서류는 반환하지 아니하며 심사를 위한 경우 이외에는 신청자의 동의 없이 신청서류의 내용을 공개하지 아니함
※원문을 확인하시려면 아래를 클릭해주시기 바랍니다.
해당홈페이지 바로가기























