전체
home 알림마당 기관별 공지사항 전체
의료기기 인·허가 규제, 전면 개편한다 !
| 작성자 | 관리자 | ||
|---|---|---|---|
| 작성일 | 2018-07-20 | 조회수 | 4,900 |
| 출처 | 보건복지부 | ||
| 원문링크 | http://www.mohw.go.kr/react/al/sal0301vw.jsp?PAR_MENU_ID=04&MENU_ID=0403&page=1&CONT_SEQ=345445 | ||
| 첨부파일 | |||
※원문 확인 및 문의를 원하시면 아래를 클릭해주시기 바랍니다.
해당홈페이지 바로가기
의료기기 인·허가 규제, 전면 개편한다 !
- 체외진단기기 시장진입, 390일 ⇨ 80일로 대폭 단축된다 -
- 연구중심병원에 ‘산·병협력단’ 설립, 산·병·연 협력의 교두보 마련 -
□ 정부는 7월 19일 관계부처 합동으로 “혁신성장 확산을 위한 의료기기 분야 규제혁신 및 산업육성 방안”을 발표하였다.
ㅇ 그간 정부는 4차 산업혁명 시대의 미래형 신(新)산업으로 혁신·첨단 의료기기 산업을 육성하기 위하여, 연구개발(R&D) 투자 규모를 확대하고, 규제기간을 단축하는 등의 노력을 해왔으나, 의료기기 분야 산업의 빠른 기술변화에 따라가지 못하고 있다는 지적이 있었다.
* 의료용 3D 프린팅 세계 시장 성장 전망 : (’17) 7.3 → (’19) 9.7 → (’21) 12.9억 달러 (연 평균 성장률 15.3%) (’16 Markets and Markets)
* 의료기기분야 정부 R&D 투자 규모 : (’12) 2,701 → (’14) 2,943 → (’16) 3,665억 원 (연 평균 성장률 : 7.9%)
ㅇ 특히, 의료기기분야는 국민 건강과 안전을 위해 정부 규제가 크게 작용하는 분야로서, 의료기기 개발 이후 시장에 진입하기까지 여러 규제과정을 거치게 되었다. (최대 520일 소요)
< 신의료기술인 경우 시장진입 절차 >
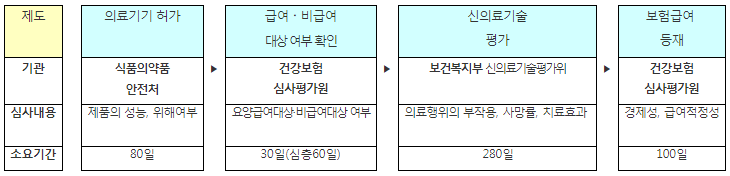
ㅇ 앞으로 정부는 안전성 우려가 적은 의료기술(의료기기)은 ‘선(先) 진입 - 후(後) 평가’방식(포괄적 네거티브 규제*)으로 대폭 혁신할 계획이다.
* 포괄적 네거티브 규제 : 사전 규제 방식 ⇨ ‘사전허용-사후규제’ 방식으로 전환
ㅇ 특히, 체외진단검사분야의 신의료기술평가는 사전평가에서 사후평가로 전환하고, 체외진단기기의 시장진입에 소요되는 기간을 기존 ‘390일’에서 ‘80일 이내’로 대폭 단축한다.
* 질병진단 등 목적으로 인체로부터 채취된 검체(혈액, 분변 등)를 이용하여 체외에서 이루어지는 검사
ㅇ 인공지능(AI), 3D 프린팅, 로봇 등을 활용한 미래유망 혁신·첨단의료기술이 최소한의 안전성이 확보된 경우 우선 시장진입을 허용한 후, 임상현장에서 3~5년간 사용하여 축적된 풍부한 임상 근거를 바탕으로 재평가를 한다.
□ 규제혁신과 더불어 의료기기 산업육성책도 함께 추진할 예정이다.
ㅇ 먼저 연구중심병원에 ‘산병협력단’ 설립을 허용하여, 병원이 혁신적 의료기술 연구와 사업화 허브로 거듭날 수 있도록 기반을 마련할 계획이다.
ㅇ 아울러, 환자진료 경험을 토대로 혁신 의료기기 개발을 선도할 연구의사 육성, 국산 의료기기 성능개선 지원, ‘의료기기산업육성법’ 제정 등 의료기기산업을 도약할 수 있는 정책을 적극 추진한다.
□ 이번 대책의 세부 추진과제는 다음과 같다.
<세부 추진 과제>
1 규제혁신 중점 추진과제
① 규제 과정의 그레이존(예측 불가능성) 해소
□ 의료기기 규제관련기관(복지부, 식약처, 심평원)의 개별적 정보제공과 규제과정의 참여제한 등을 해소하기 위하여 ‘의료기기산업 종합지원센터’ 기능을 강화하고, 의료기기 규제절차에 대한 전(全) 주기 통합상담을 실시한다.

ㅇ 특히, 각 규제기관별 홈페이지와 연동되는 ‘통합정보포탈(portal) 시스템’을 구축하여, 규제정보 등에 대한 접근성을 증대해 나갈 계획이다.
* 각종 규제관련 정보 외에 시장분석 보고서 발간, 해외 전문정보 DB제공 등
□ 규제 진행과정(규제기준, 심의결과 등)을 신청인에게 적극 공개하고, 참여 보장*을 강화시킴으로써, 규제 과정의 투명성을 제고할 계획이다.
* 의료기기 허가 : 신청인이 제품의 특이성을 심사관에게 직접 설명하는 기회부여
* 신의료기술평가 : 위원회의 최종 결정 전에 신청인에게 필수적으로 의견진술 기회 부여
ㅇ 관련 협회 등의 추천을 받아 혁신·첨단기술 전문가를 평가위원군(pool)에 추가 영입하여 평가위원*으로 위촉한다
* 신의료기술평가위원회 및 소위원회, 보험등재 심의 담당 전문평가위원회(행위, 치료재료)
ㅇ 특히, 신의료기술평가의 심사 문헌범위, 심사기준, 평가결과(탈락한 기술의 심의결과서 등)를 공개하는 절차를 복지부 고시에 명확히 규정한다.
② 인·허가 과정의 실질적 원스톱 서비스 체계 구축
□ 규제기간을 단축하기 위해 신의료기술평가의 절차를 간소화*하고, 보험등재심사와 신의료기술평가를 동시에 진행**하는 방안을 마련할 계획이다.
* 신의료기술평가 대상심의 절차 간소화 : 평가기간 30일 단축 (280→250일)
** 신의료기술평가-보험등재심사 동시 진행 : 100일 단축 (490→390일)
□ 통합심사(의료기기허가-신의료기술 평가)는 ‘통합심사 전담팀’(식약처, 보의연, 심평원)을 구성하여, 신청인과의 창구를 선임책임담당자(식약처)로 일원화함으로써, 중복 자료요청의 혼선을 제거하고, 통합운영 심사시스템*으로 자료를 공유할 계획이다.

③ 혁신·첨단의료기술 조기 시장 진입 지원
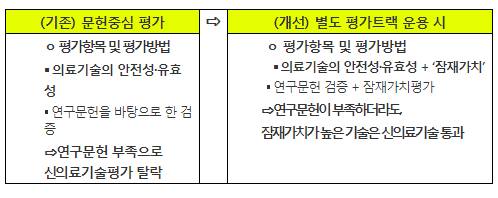
□ 개발이력이 짧고 연구결과가 부족하여 신의료기술평가에서 탈락하던 혁신·첨단 의료기술을 신속하게 시장에 진입할 수 있도록 선제적 인허가 체계와 혁신가치에 대한 보상방안을 마련한다.
ㅇ (식약처) 의료기기 허가 단계에서 혁신·첨단의료기기가 개발과 동시에 신속하게 허가되도록 하는 ‘신속허가 가이드라인’을 구축한다.
ㅇ (심평원) ‘의료진의 편의 및 생산성’을 증진시키는 의료기술*은 예비분류 코드** 혹은 심평원의 확인증 발급을 통해 조속히 시장에 진입(신의료기술평가 절차 생략)하도록 한다.
* (예) AI 기반 영상진단보조프로그램 : 영상진단속도를 향상시켜 생산성을 증진
** 보험수가를 별도 받지는 못하지만, 해외시장에서 국내 보험 등재 여부를 확인할 때 활용하는 일종의 가상 코드
ㅇ (복지부) 연구결과 축적이 어려운 혁신·첨단 의료기술은 문헌 근거가 다소 부족하더라도 혁신·첨단 의료기술의 잠재가치를 추가적으로 고려하여 시장 진입을 허용하는 별도 평가트랙을 운용한다.
< 별도 평가트랙 운용 시 효과 >
ㅇ (심평원) 기술혁신·개량 치료재료에 대한 가치평가 제도 개선*으로 적정 보상체계를 마련한다.
* 환자 안전에 기여하고 기술혁신 평가인증시, 기술혁신에 대한 가치상향 조정
* 유망기술과 근거개발 장려가 필요한 경우, 기술개발노력 가산제도 신설
➃ 안전한 의료기기‘포괄적 네거티브 규제’도입
□ 인체 안전성에 우려가 적은 의료기기의 경우, ‘선(先) 진입-후(後) 평가’ 방식(포괄적 네거티브 규제)으로 규제를 혁신한다는 방침이다.
ㅇ 체외진단검사분야에 대한 신의료기술평가를 사전평가에서 사후평가로 전환하여, 체외진단기기는 개발 후 1년 넘게(390일) 걸리던 시장진입을 80일 이내로 대폭 단축한다.
- 체외진단검사분야 신의료기술평가 대상 : 87건(’16년)
- 체외진단기기 시장진입 소요기간 : 390일 ⇨ 80일 이내 (최대 310일 단축)
ㅇ 체외진단기기가 기존 기기와 비교시 중대한 변경(예: 사용목적 등)이 아닌 경미한 변경사항이 있을 경우, 식약처의 변경허가(60일 소요)가 면제된다.
- 식약처 변경허가 대상 : 713건 → 427건 (’17년 기준대비 40% 감소 예상)
2
산업육성 중점 추진과제
① 의사·병원의 의료기기 연구 및 산업화 역량 강화
□ 정부는 혁신적 의료기기 연구개발(R&D)과 사업화의 주체인 병원과 연구의사의 역량을 강화하여 의료기기 산업 육성을 위한 생태계 혁신을 추진한다.
□ 【병원 혁신】 병원이 의료기기 연구개발에서 그치지 않고 그 성과를 실용화하여 창업까지 할 수 있도록 적극적 참여를 유도해갈 계획이다.
ㅇ 먼저, 연구중심병원을 중심으로 혁신적 의료기술 연구와 실용화를 저해하는 제도적 장벽을 해소한다.
- ‘산병협력단 등 병원의 의료기술 특허 사업화와 창업 지원을 전담할 수 있는 자체 조직 설립을 허용하여, 산병연협력체계를 구축한다.
ㅇ (연구중심병원) 지정제를 인증제로 전환하는 방안을 마련하여 연구역량을 갖춘 병원을 단계적으로 연구중심병원으로 육성할 계획이다.
- 이밖에도 연구중심병원과 지역 거점병원 간 컨소시엄(’18.7월, 3개 지원)을 구성하여, 지방병원 연구역량을 높이고,
- 또한, 과기부와 함께 지역 거점병원을 지역 혁신성장의 거점으로 육성하기 위해 19년부터 기업․대학․출연연 등의 공동 연구를 지원할 예정이다.
□ 【연구의사 육성】환자 진료경험을 토대로 혁신적 의료기기 개발을 이끌 주체로서 연구의사 양성체계를 강화할 계획이다.
ㅇ 먼저, 연구역량을 갖춘 병원을 중심으로 수련 전공의부터 신진ㆍ중견의사 단계별로 임상 연구의사 양성여건을 조성할 계획이다.
- 복지부와 과기정통부는 진료시간을 단축하여 연구시간을 보장하고, 의사가 병원과 정부로부터 연구 공간ㆍ장비와 연구비를 제공받아 연구자로 독립할 수 있도록 지원할 계획이다.
ㅇ 대학 내에서 임상의사와 기초연구 과학자와의 협업연구를 지원하기 위해,
- 기초의과학 분야 대학원이 설치되어 있는 대학에 지원하는 선도연구센터(MRC, 35개)에 병원 임상의사 등이 30% 이상 참여하도록 의무화할 계획이다.
* Medical Research Center : 기초의과학(의·치·한의·약학) 분야 대학원이 설치되어 있는 대학의 연구자 10인 내외 연구그룹의 특성화 연구를 지원
② 국산 의료기기 성능 강화, 경쟁력 확보
□ 정부는 국산 의료기기 기술개발 경쟁력을 높이고 성능을 강화하여 글로벌 기업 수준의 경쟁력을 확보할 수 있도록 지원체계를 갖추어 나가고자 한다.
* 국내 병원의 국산 의료기기 점유율(’13년) : 전체(59.7%), 병원급(54%), 종합병원(19.9%), 상급종합병원(8.2%), 출처: 2014년 보건산업진흥원 유통실태조사
* 국산의료기기 사용 기피요인 : 제품 성능 부족(20%), 브랜드 인지도 부족(20%), 전문가 권고 부족 및 사용경험 부재(12.3%) 등, 출처: 2014년 보건산업진흥원 유통실태조사
* 최고기술보유국(美) 대비 국내 기술 격차(’17년) : 의료영상융합기술(2.8년), 생체적합 재료개발기술(2.6년), 초정밀 의료용로봇기술(3.7년), 재활치료(4.6년)
□ 【국산 의료기기 수준 향상】복지부는 국산 의료기기 성능 개선 및 외국 제품과의 비교 테스트(성능 동등성 입증)를 위한 병원 테스트베드* 지원 사업을 대폭 확대할 계획이다.
ㅇ 실제 테스트베드 지원 사업에 참가한 기업의 경우 국내 상급종합병원에 의료기기 제품 납품을 시작하였으며 이를 통해 매출액이 49%까지 증가한 사례가 있다.

ㅇ 국산 의료기기 사용률이 높은 병원이 국가 연구개발(R&D) 사업에 참여할 경우, 선정평가 가점을 부여하는 방안을 복지부ㆍ과기정통부ㆍ산업부가 마련할 계획이다.
□ 【R&D 통합 및 수행체계 효율화】관련 부처(복지ㆍ과기ㆍ산업ㆍ식약)가 협력하여 의료기기 R&D사업을 범부처 사업으로 통합하여 현장자원 융합을 꾀할 계획이다.
ㅇ 통합 사업은 단일법인을 설립하여 운영하고 인허가ㆍ건강보험 관련 기관도 참여하여 수요자 대상 원스톱 서비스를 지원할 계획이다.

③ 의료기기 산업 육성을 위한 기반(인프라) 확충
□ 【법적 체계 마련】의료기기 업계의 오랜 요구사항인 ‘의료기기산업육성법’과 ‘체외진단기기법’을 각각 제정, 산업 육성을 위한 법적체계를 강화할 계획이다.
ㅇ 복지부는 국회와 협력하여 의료기기에 대한 규제와 산업 육성 정책간의 조화를 위한 ‘의료기기산업육성법’ 제정을 추진하고 있다.
* 양승조 의원 대표 발의 (’17년 9월 12일 발의, 복지위 법안소위 계류 중)
- ‘혁신형 의료기기’ 기업 지정 및 지원, 관련 기업의 연구개발 지원을 통하여 인공지능, 3D프린팅 등 혁신적 의료기기 개발이 가능한 산업 생태계 조성을 꾀할 계획이다.
- 특히 혁신의료기기의 경우에는 지원․육성과 관련된 내용 외에 신속허가 등의 조항을 담아* 빠른 제품화 및 시장진입을 지원할 예정이다.
* 오제세 의원 대표 발의한 ‘첨단의료기기 허가 및 기술지원 특별법’(식약처)과의 조정안 마련
ㅇ 식약처는 체외진단의료기기의 기술적 특성에 맞는 법률 체계를 마련하기 위해 ‘체외진단의료기기법’ 제정을 추진할 계획이다.
* 김승희, 전혜숙 의원 대표 발의 (’17년12월22일 / ’17년12월29일 발의, 복지위 계류 중)
□ 【전주기 창업 지원】 복지부는 ‘보건산업 초기 기술창업펀드(민․관 총 300억 원 이상 규모)’*를 올해 8월부터 운영할 계획이다.
* 바이오헬스산업 분야 5년 이내 초기 창업기업에 60% 이상 투자 계획
ㅇ 창업 초기 의료기기 기업에 투자하고 투자기업 진단 결과에 따라 맞춤형 엑셀러레이팅(교육, 컨설팅, IR 등)을 제공하고자 한다.
ㅇ 또한 올해 2월부터 운영 중인 ‘보건산업 혁신창업지원센터’를 통해
- ‘기술 스카우터’를 활용한 실험실 유망 아이디어(기술) 발굴과 전문가 멘토링, 투자유치 지원(Investor Relations) 등을 통하여 창업 의료기기 기업의 성장을 지원하고 있다.
□ 【의료정보 공유】 의료기기 인허가 규제혁신 뿐만 아니라 의료분야 연구개발 및 사업화의 중요한 자원인 의료 데이터 활용을 활성화하고, 건강관리 차원에서 국민 스스로 건강정보를 활용할 수 있도록 지원할 계획이다.
<기대 효과>
□ 박능후 보건복지부 장관은 “이번 대책이 국내 의료기기 산업분야가 성장하고, 국내 기업이 세계 시장으로 진출할 수 있는 교두보 역할을 할 것으로 기대”한다고 하였다.
ㅇ 아울러, “연구중심병원내 산병협력단 등이 설립됨으로써 안정적인 연구인력 고용이 가능해져 좋은 일자리도 창출”되고,
ㅇ “지역 거점병원과 연구중심병원ㆍ기업ㆍ대학 등과의 공동 연구를 통해 지역의 혁신성장은 물론 지역경제도 활성화될 것”이라고 밝혔다.
□ 박능후 장관은 마지막으로 “다만, 의료기기 분야는 국민의 생명과 직결되는 분야이므로 국민의 안전을 최우선으로 고려하면서, 규제를 혁신해 나갈 것임”을 강조하였다.























