통계간행물
home > 자료실> 통계간행물
- 글자크기
암세포 타깃용 새로운 광감각제 개발
| 작성자 | 관리자 | ||
|---|---|---|---|
| 작성일 | 2022-08-09 | 조회수 | 469 |
| 원문 | ibric.org/myboard/read.php?Board=news&id=343992&Page=1&PARA0=7 | ||
| 출처 | Bio통신원 | ||
저산소에서 암세포 사멸시킬 수 있는 새로운 광감각제 개발 발판 마련
암세포 타깃을 위한 새로운 광감각제가 개발됐다.
광감각제(Photosensitizer)는 특정 고유 파장의 빛을 흡수하여 여기(excitation)될 때 주변 산소를 산소종(산소라디칼, superoxide, 및 peroxide)으로 바꾸어줄 수 있는 물질이다. 이렇게 만들어진 활성산소의 강력한 산화력으로 암세포나 세균을 공격해서 죽일 수 있다. 이러한 방법으로 암세포를 사멸시킬 수 있는데, 이를 광역학치료법(photodyanamic therapy)이라고 한다.
그러나 대부분 종양 환경은 저산소상태(pO2 < 5 mm Hg)이기 때문에 산소 기반 광역학 치료법(PDT)이 그리 쉽지 않다. 이를 극복하기 위해 고려대학교 이과대학 화학과 김종승 교수 연구팀은 산소 비의존성 광역학 치료제를 개발하기 위해 10여년 이상 연구했고, 드디어 그 결실을 보게 되었다.
김종승 교수((주) 테라노켐 대표)팀이 새롭게 개발한 산소 비의존성 광감각제(photosensitizer)는 활성산소종 중의 하나인 슈퍼옥사이드 라디칼(superoxide radical, O2-•)을 발생시키고, 저산소성 T47D(인간 유방암 세포주) 세포의 증식을 억제하고, 3D 다세포 스페로이드(MCS)의 성장을 현저하게 억제하는 것을 확인했다.
특히 암 사멸 기전중의 하나로 알려진 파이롭토시스(pyroptosis)는 최근에 종양학에서 연구의 화두가 되고 있다. 지금까지 파이롭토시스를 유도하여 암치료하는 방법은 doxorubicin과 topotecan과 같은 약물을 사용하는 화학요법이 있는데, 이런 약물은 약물내성이 발생하고, 정상조직에서는 심각한 부작용이 발생할 수 있다고 알려져있다. 이러한 부작용을 방지하기 위해 김종승 교수 연구팀은 화학요법이 아닌 산소 비의존성 광역학치료제를 개발했다. 이렇게 산소 비의존성 광역학치료제로 파이롭토시스를 유도하여 암세포를 사멸하는 기전은 전세계에서 처음이라고 할 수 있다.
* 파이롭토시스(Pyroptosis) : 세포 내 병원체에 감염될 때 가장 자주 발생하며 항균 반응의 일부를 형성할 수 있는 세포 사멸 기전중의 하나이다. 면역 세포에서 발생할 수 있으며 각질 세포 및 일부 상피 세포에서도 발생함
한국연구재단이 지원하는 리더연구자지원사업의 지원으로 수행된 이번 연구 결과는 미국화학회지(Journal of the American Chemical Society)에 2022년 6월 16일에 게재됐다.
주요내용 설명
<작성 : 고려대 김종승 교수>
논문명
Photocatalytic Superoxide Radical Generator that Induces Pyroptosis in Cancer Cells
저널명
Journal of the American Chemical Society
키워드
Hypoxia, pyroptosis, superoxide radical, photodynamic therapy, singlet oxygen
DOI
https://doi.org/10.1021/jacs.2c03256
저 자
김종승 교수 (교신저자/고려대학교), Mingle Li (공동교신저자/고려대학교) Jonathan Sessler (공동교신저자/텍사스대학교), Le Yu (제1저자/고려대학교) Yunjie Xu (공동저자/고려대학교), Zhongji Pu (공동저자/Zhjiang Univ), 강희민 교수 (공동저자/고려대학교)
1. 연구의 필요성
○ 광역학치료(photodynamic therapy)의 기본개념은 광감각제(photosensitizer)가 빛(light)과 산소(oxygen)와의 화학적인 상호반응을 유도하여 일항산소(singlet oxygen)와 자유라디칼(free radical)이 인체 내부에서 암세포만 선택적으로 괴사시키는 광 치료법이다. 레이저가 아닌 빛을 이용한 치료법은 수천 년 전부터 시작되었으나, 광역학치료는 최근 수십 년의 짧은 역사를 가지고 있는 새로운 치료 기술이라고 할 수 있다.
○ 광역학치료의 필수적인 3가지 요소는 광원(light), 광감각제(photosensitizer), 그리고 산소(oxygen)이다. 적절한 파장과 적절한 양의 빛을 조사하여 광감각제를 활성화시키면, 활성화된 광감각제가 직접 작용하거나, 활성산소를 생성하여 표적세포에 작용하게 된다. 광감각제는 정맥에 주입하거나 피부에 도포하는 방법 등 다양한 방법으로 투여가 가능하다. 암세포에 광감각제가 축적이 되면 빛이 흡수됨에 따라 광감각제는 기저상태(single state)에서 상대적으로 오랫동안 전기적 활성상태를 가질 수 있는 삼항상태(triplet state)으로 변형되며, 활성화된 삼항(triplet)은 두 가지 종류의 반응을 일으킨다.
○ 두 가지 종류의 광역학 반응 중 우선 첫째 반응 (Type-1)은 직접적으로 세포막이나 분자에 반응을 하여 전자 혹은 수소원자의 운송이 일어나면서 라디칼(radical)을 생성해 산화반응을 통하여 세포 독성을 일으킨다. 다른 반응 (Type-2)은 triplet 상태인 광감각제가 직접적으로 산소에 에너지를 전달하여 단일항산소(singlet oxygen)을 생성하고 불포화 지방산이나 콜레스테롤, 단백질, DNA 등에 반응하여 세포 독성을 일으킨다. 대부분의 광역학치료 효과는 산소 의존적이므로 광감작제의 활성화는 조직의 무산소부위에서는 나타나지 않는다. Type 1, 2 반응은 동시에 발생하며, 이 과정들 사이의 비율은 광감각제의 유형, 광감각제의 농축정도, 산소의 농도, 광감각제와의 결합력에 달려 있다. 높은 반응력과 활성 산소 (Reactive Oxygen Species, ROS) 의 짧은 반감기 때문에 오직 ROS가 생성되는 근처 부위의 세포만 광역학치료의 영향을 직접적으로 받게 된다.
○ 본 연구에서는 광역학 치료 메커니즘 중 Type 1 광화학반응을 통해 산소라디칼에 의해 발생된 파이롭토시스를 이용하여 저산소증에서도 효과적으로 암세포를 사멸시킬 수 있는 전략을 처음으로 제시하였다.
2. 연구내용
○ 본 연구에서 광감각제 (NI-TA)의 항종양 효과를 3D 종양 모델을 이용하여 입증하였다. 암세포인 T47D에 NI-TA를 투여하고 광조사(50 mW/cm2, 20분)를 했을 때 슈퍼옥사이드 라디칼 (O2-•)가 효과적인 생성되었다. 또한, 이러한 조건에서 종양크기가 95 % 이상으로 크게 감소하였다. Calcein AM/PI 염색을 통해 3D 종양 모델의 T47D 세포가 파이롭토시스 활성화되어 세포 사멸되었다는 것을 알게 되었다. 대조군으로 NI-TA 대신 NI-DF를 사용한 경우에는 이러한 결과가 관찰되지 않았다. 또한 2.5μM NI-TA를 처리하고 광조사를 하면 ATP 수준이 대조군의 1% 미만으로 떨어졌다. 이것은 세포 사멸로 인한 ATP가 분해되었다고 볼 수 있다.
○ NI-TA가 특정 산소 라디칼 발생 프로브인지의 여부를 테스트하기 위해 광조사(백색광, 35 mW/cm2)을 실시하였다. 광조사시, NI-TA에 의해 생성된 일중항 산소와 하이드록실 라디칼이 거의 없다는 사실으르 알게되었다. 광조사 시 NI-TA는 광자를 흡수하여 여기된 단일항 상태(1[NI-TA*])를 생성하고, 시스템 간 교차(ISC) 후 해당 삼중항 상태(3[NI-TA*])가 형성하고 이때 O2−•가 생성된다.
3. 연구성과/기대효과
○ 고형암 치료에서 광감각제를 사용하는데 문제점 중의 하나는 산소의존성인데, 고형암은 산소가 비축적되어 있어서 이러한 광감각제로 치료가 비효률적이라고 알려져 왔다. 본 연구팀은 산소 비의존성 광역학 치료제를 개발하였고, 그 광감각제는 활성산소종 중의 하나인 슈퍼옥사이드 라디칼 (superoxide radical, O2-•)을 선택적으로 발생시키고, 저산소성 T47D(인간 유방암 세포주) 세포의 증식을 억제하고, 3D 다세포 스페로이드(MCS)의 성장을 현저하게 억제하는 것을 확인하였다.
○ 본 연구팀은 광조사 조건에서 암세포에서 파이롭토시스를 유발하는 광촉매 활성산소종 산소 라디칼 발생 프로브인 NI-TA를 개발하였다. NI-TA는 저산소 조건(2% O2)에서 시험관 내 파이롭토시스를 촉진하는데 효과적인 것으로 입증되었으며, 이는 낮은 O2 의존 특성에 기인한다. 또한, NI-TA는 T47D 3D MCS에서 테스트 되었으며 우수한 항종양 효능과 줄기세포를 억제하는 능력을 나타내었다. 특히, NI-TA + 빛의 조합이 MCS에서 암줄기세포(CSC)를 제거하는 데 효과적이라는 결론을 낼 수 있었다.
○ 본 연구 결과로 부작용이 없는 고형암 광역학치료법 연구에 한 걸음 더 다가갈 수 있고, 화학요법 (chemotherapy) 의 심각한 부작용을 최소한으로 줄일 수 있는 계기가 될 수 있다고 사료된다.
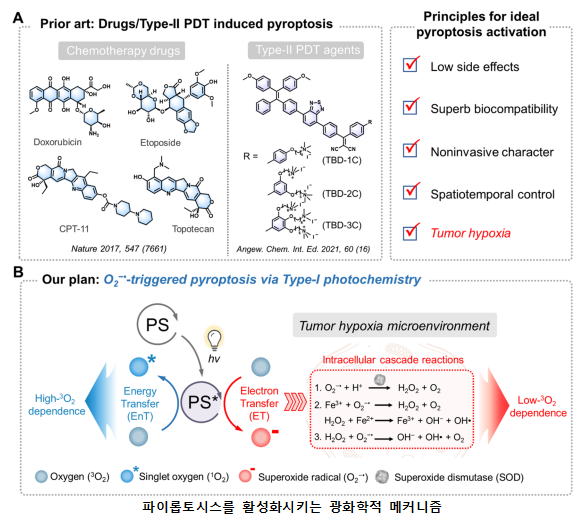
기존 연구들이 주로 Type-2 광역학치료 메커니즘에 의존하는 반면, 본 연구에서는 Type-1 메커니즘을 경유하기 때문에 산소에 덜 의존적이어서, 저산소증에서도 효과적으로 그리고 비침습적으로 암세포를 사멸시킬 수 있다. 또한 부작용이 적고 생체적합성 또한 우수함을 입증하였다.
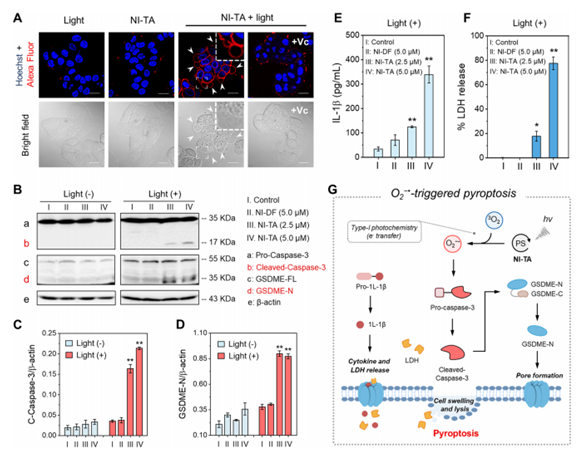
(그림: 공초점 현미경으로 정상 및 pyroptotic T47D 세포의 형태학적 특징 및 타입1 산소 라디칼 생성을 경유하는 파이롭토시스 활성화 메커니즘을 밝힘)
김종승 교수 연구팀은 pyroptosis 활성화의 기본 경로를 탐색하기 위해 T47D 세포에서 Western blot assay를 수행하였다. 광조사 시, NI-TA 처리군(2.5 및 5.0 μM)에서 cleaved-caspase-3 및 GSDME의 N-말단 단편(GSDME-N)의 발현이 증가하였지만, NI-DF 처리(5.0 μM) 및 대조군에서는 그런 현상이 없었다. 이러한 발견은 광 생성된 산소 라디칼이 caspase-3/GSDME 경로를 통해 pyroptosis의 활성화를 매개한다는 개념을 뒷받침한다.
* 그림 및 그림설명 제공 : 고려대학교 김종승 교수
출처: [BRIC Bio통신원] 암세포 타깃용 새로운 광감각제 개발 ( https://www.ibric.org/myboard/read.php?Board=news&id=343992 )








