의약품 시장 현황
일본 면역물품 시장동향
| 작성자 | 관리자 | ||
|---|---|---|---|
| 작성일 | 2022-12-19 | 조회수 | 802 |
| 국가정보 | 아시아>일본 | ||
| 출처 | KOTRA | ||
| 원문 | https://dream.kotra.or.kr/kotranews/cms/news/actionKotraBoardDetail.do?pageNo=12&pagePerCnt=10&SITE_NO=3&MENU_ID=170&CONTENTS_NO=1&bbsGbn=01&bbsSn=243%2C403%2C257%2C254&pNttSn=198377&recordCountPerPag | ||
2020년 일본 국내 독감 백신의 수요 증가
신규 백신 개발을 위한 기술연구 협업 필요
상품 기본정보
ㅇ 상품명: 면역 물품 (HS Code 3002.15)
|
HS Code |
품목명 |
기본 관세, RCEP 관세 |
|
3002.15 |
면역 물품(투여, 소매, 포장용에 한함) 백신, 독소, 배양 미생물(효모 제외), 기타 유사 제품 |
무관세 |
[자료: 일본 관세율표(2022.4.1. 기준)]
일본 백신 시장동향
일본은 1990년대까지 감염병에 대한 연구가 활발히 진행돼 국내 의약품 중에서 감염병 분야가 상위 점유율을 차지하고 있었다. 이후 점차 공중위생이 향상되면서 백신 시장은 대폭 감소했으나, 2020년에 독감 백신의 수요가 50% 이상으로 늘어나면서 약 2,500억 엔 규모의 시장으로 확대됐다.
전 세계 백신 시장에서는 미국이 압도적인 점유율을 확보하고 있으며, 일본은 약 8%에 불과하나 상위 2위 국가로서 중요한 위치를 차지하고 있다.
<2020년 백신 시장 점유율>
(단위: %)
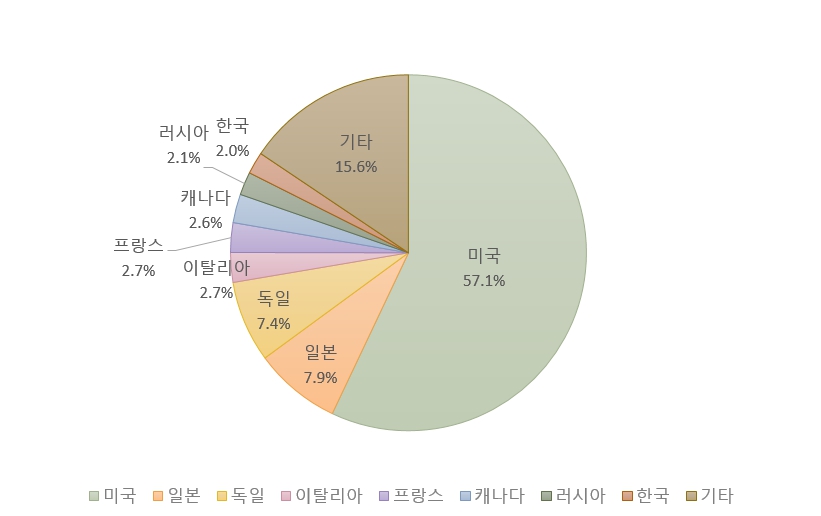
[자료: IQVIA Reports 2022]
일본 국내에서는 1994년 A형 간염의 백신이 승인된 이후 약 10년 동안 신규 감염병에 대해 승인된 백신은 없었으나, 2005년부터 미국∙유럽을 중심으로 지속적으로 새로운 백신이 개발되면서 2020년까지 의약품∙의료기기 종합기구(PMDA)에서 승인된 백신*은 33개 품목에 이른다.
*주) PMDA 승인 품목 중 일본 기업이 창출한 백신은 약 40%, 미국 30%, 프랑스 12%, 이탈리아 10%, 호주 8%
<일본의 백신 개발 현황>
(단위: 품목 수)
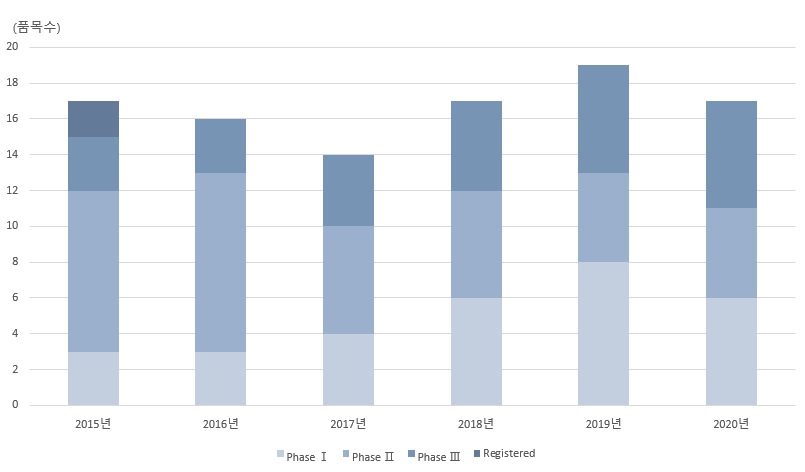
* 임상시험 단계: 일상(Phase1) 시험은 새로운 치료의 가장 적합한 방법 및 용량을 확인하는 과정이며, 이상(Phase2) 시험은 유효성과 안전성을 증명하기 위한 단계이고, 삼상(Phase3) 시험은 새로운 치료의 유효성을 어느 정도 확립한 후 기존 치료와 비교하는 과정이며, 마지막 사상(Phase4) 시험은 시판 후 삼상 시험에서는 확인되지 않았던 안전성 및 장기적 부작용 등을 검토하고, 추가 연구를 시행하는 과정
[자료: Pharmaprojects Informa 2022]
2022년 1월 기준 일본 기업이 개발한 백신(코로나19 제외)은 15개 품목이며, 그중 그룹사 등이 해외에서 자체 개발하고 있는 품목은 8개다. 일본 국내에 신규 백신을 도입하기 위해 해외에서도 일본 기업의 연구개발이 활발히 진행되고 있다.
<일본 국내 도입을 검토 중인 백신>
|
- MMR 백신 (신청 중) - 13가 폐렴구균 결합형 백신 (소아: 승인 완료, 고령자: Phase Ⅲ) - 9가 HPV 백신 (Phase Ⅲ) - 말라리아 백신 - 웨스트 나일 백신 - MR-V 혼합 백신 - 대상포진 백신 - 사이토메갈로 바이러스 백신 (Phase Ⅲ) - 노로바이러스∙로타바이러스 혼합 백신 (비임상) |
[자료: 일본 후생노동성]
현재 일본에서 정기 접종을 권장하고 있는 백신은 A∙B류 질병에 따라 분류된다. A류 질병으로는 결핵, 디프테리아, 파상풍, 백일해, 소아마비, 홍역, 풍진, 일본 뇌염, Hib(독감균 B형) 감염증, 소아 폐렴구균 감염증, 수두, 인유두종 바이러스 감염증, B형 간염 등이 있다.
<일본의 정기∙임의 접종 대상 백신>
|
구분 |
감염병 분류 |
백신명 |
|
정기 접종 |
집단 예방 목적 (A류 질병) |
Hib 백신 (세균성 수막염, 후두개염 등) |
|
소아용 폐렴구균 백신 (세균성 수막염, 패혈증, 폐렴 등) |
||
|
B형 간염 백신 |
||
|
로타바이러스 백신 (감염성 위장염) |
||
|
4종 혼합 백신 (디프테리아, 백일해, 파상풍, 소아마비) |
||
|
BCG (결핵) |
||
|
MR(홍역∙풍진 혼합) 백신 |
||
|
수두 백신 |
||
|
일본 뇌염 백신 |
||
|
HPV 백신 |
||
|
개인 예방 목적 (B류 질병) |
독감 백신 *고령자 대상 |
|
|
성인용 폐렴구균 백신 *고령자 대상 |
||
|
임의 접종 |
- |
유행성 이하선염 백신 |
|
3종 혼합 백신 (디프테리아, 백일해, 파상풍) |
||
|
독감 백신 |
||
|
A형 간염 백신 |
||
|
수막염균 백신 |
[자료: 후생노동성, 도쿄의사회]
수입동향
2022년 9월 기준 일본의 면역 물품 수입 금액은 약 9,430억 엔으로, 전년 동기 대비 25.5% 증가했다. 상위 수입 국가는 미국 약 31%, 스위스 15%, 독일 15%이며, 3개국이 60% 이상의 점유율을 차지하고 있다.
한국은 2021년까지 5위를 유지하고 있었으나, 2022년에 이탈리아로부터의 수입이 530.9% 급증해 현재는 7위(점유율 3.03%)를 차지하고 있다. 코로나19의 영향으로 면역 물품에 대한 중요성이 높아지고 있어, 향후에도 일정 수량으로 수입이 늘어날 것으로 예상된다.
<면역 물품(HS Code 3002.15) 수입 규모>
(단위: 천 엔, %)
|
순위 (’22) |
국가 |
수입액 |
증감률 |
점유율 |
||
|
2020 |
2021 |
2022.9 |
||||
|
- |
전 세계 |
857,647,446 |
1,047,540,129 |
942,980,144 |
25.5 |
100 |
|
1 |
미국 |
182,751,539 |
284,588,957 |
288,965,028 |
44.1 |
30.64 |
|
2 |
스위스 |
130,884,706 |
151,675,011 |
139,420,176 |
20.2 |
14.79 |
|
3 |
독일 |
177,028,497 |
181,667,387 |
139,118,275 |
14.3 |
14.75 |
|
4 |
아일랜드 |
190,143,478 |
221,049,641 |
121,476,462 |
-25.7 |
12.88 |
|
5 |
이탈리아 |
11,357,769 |
28,999,742 |
86,049,641 |
530.9 |
9.13 |
|
6 |
푸에르토리코 |
27,465,668 |
23,002,443 |
31,055,688 |
100.7 |
3.29 |
|
7 |
한국 |
22,305,105 |
30,556,001 |
28,533,807 |
18.4 |
3.03 |
|
8 |
영국 |
21,091,492 |
26,826,560 |
27,177,447 |
26.5 |
2.88 |
|
9 |
프랑스 |
23,983,849 |
26,288,910 |
24,950,827 |
33.5 |
2.65 |
|
10 |
네덜란드 |
28,852,500 |
22,576,558 |
21,322,148 |
36.5 |
2.26 |
[자료: 한국무역협회 K-stat (2022.11.15. 기준)]
경쟁동향
일본제약공업협회 회원사 중 치료제 및 백신을 연구개발하고 있는 제약회사는 23개사이며, 주요 일본 기업의 백신 개발 추진 현황은 다음과 같다.
<일본 제약회사의 백신 개발 현황>
|
기업명 |
현황 |
|
|
- 2021년 10월 자회사 KM Biologics와 Meiji Seika Pharma가 코로나19 불활성화 백신 KD-414의 임상시험을 실시 - 2022년 8월 Meiji Seika Pharma는 코로나19 차세대 mRNA 백신 ARCT-154를 개발 중인 Arcturus Therapeutics와 일본 국내 제조 판매를 위해 협업 시작 |
|
|
- Meiji Holdings의 자회사로, 인간용∙동물용 백신, 혈장분획제제를 취급하는 국내 유일의 Biologics 회사 - 자사가 보유한 기술·설비를 활용해 국립감염증연구소, 도쿄대학교 의학연구소, 의약기반·건강·영양연구소와 협력하며 비임상시험용 약독 생백신의 제조 및 실용화를 목표로 코로나19 백신을 개발 중 |
|
|
코로나19 중증화 인자 탐색을 목적으로 일본감염병학회와 공동연구 중 |
|
|
- COVID-19 Therapeutics Accelerator에 참여해 미국 VBI사의 백신 후보에 추가될 보조제(E6020)를 제공 - 2020년 9월 코로나19 진단법, 치료제, 백신에 대한 글로벌 접근성 확대를 위해 생명공학기업, B&MGF와 공동성명을 발표 |
|
|
- 면역질환, 선천성 질환, 희귀질환, 종양학, 당뇨병, 순환기 질환, 내과 질환 영역의 의료용 의약품 및 백신을 제공 - 글로벌 백신 사업부에서 과거의 SARS 백신 개발 사례를 활용해 코로나19 백신 개발에 주력 중 |
|
|
- 감염병 예방과 치료를 중점 사업으로 추진하는 제약사로서 공공기관, 학계, 협력사 등과 코로나19 치료제 및 백신을 개발 중 - 국립감염증연구소, 교토대학교와 협력해 자사 그룹사 UMN Pharma가 보유한 BEVS를 활용한 유전자 재조합 단백질 백신을 개발 중 |
|
|
- 자사가 개발한 신규 핵산송달기술을 이용해 코로나19 mRNA 백신을 개발 중 - ‘신종 독감 백신 개발·생산체제 정비사업’을 통해 국산 코로나19 백신의 조기 공급을 위한 생산체제 정비 중 |
|
|
- 자회사 Medicago에서 식물 바이러스 유사 입자(VLP) 백신 ‘COVIFENZ(MT-2766)’ 개발을 위해 2021년 10월 일본에서 제 1/2상 임상시험을 시작, 2022년 2월 캐나다에서 승인 취득 - 2021년 2월 게이오대학교 의과대학과 코로나19 치료에 응용 가능한 중화항체 공동연구계약 체결 |
|
|
VLP Therapeutics Japan 합동회사가 개발하는 코로나19 차세대 mRNA 백신의 시험약 제조 중 |
[자료: 일본제약공업협회]
유통구조
백신은 주로 의약품 도매업 또는 유통업체를 통해 보급되고 있다. 일본 정부는 코로나19 이후 백신 접종 원활화 시스템(V-SYS)을 구축해 모든 국민이 공정하게 접종할 수 있도록 지자체 및 의료기관과 협력해 백신 접종을 적극적으로 지원하고 있다. 국가∙도도부현(都道府県)∙시정촌(市町村)은 백신의 할당량을 조절, 도매업자는 각 의료기관 등에 백신을 공급, 의료기관 등은 접종 실적과 백신 재고량을 담당 기관에 보고함으로써 백신 유통 과정을 철저히 관리하고 있다.
<백신 유통구조>
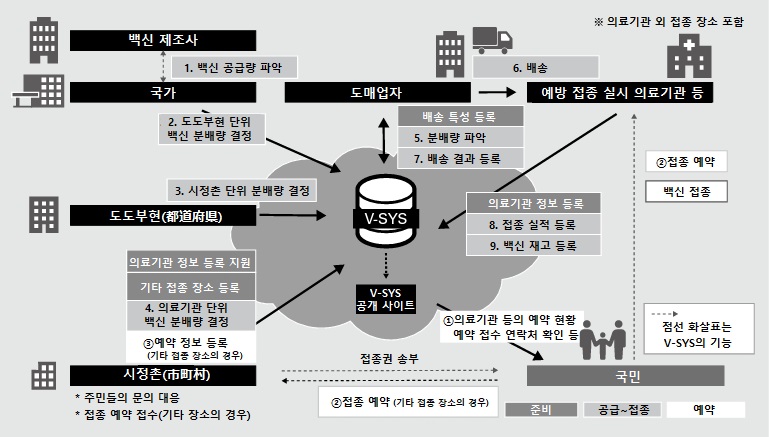
[자료: 노무라종합연구소]
인증 및 관련 기관
백신을 유통하기 위해서는 후생노동성에 ‘약사 승인’을 신청해야 한다. 개발 배경, 임상시험 및 비임상시험 내용, 품질관리방법 등 관련 서류를 제출한 후 의약품∙의료기기 종합기구(PMDA), 제 3자 인증기관, 도도부현 등의 심사를 거친다.
<관련 기관>
|
구분 |
명칭 |
URL |
|
기관 |
일본제약공업협회(JPMA) |
|
|
의약품·의료기기 종합기구(PMDA) |
||
|
의약산업정책연구소 |
[자료: 각 기관 홈페이지]
시사점
백신은 생물학적 제제로 분류되는 제조공정을 거치는 경우가 대부분이기 때문에 개발에 비용과 시간이 많이 소요된다. 일본은 대규모 백신에 대한 임상시험 경험이 없고, 1개 질병에 대해 1품목의 백신만 정기 접종 대상으로 승인된 경우가 많아 해외에서 개발된 백신에 대부분 의존하고 있는 상황이다.
일본 경제학자 M씨는 “2022년 상반기 의약품 전체 수입액 중 백신이 차지하는 비율이 매우 높다. 대기업이 아니면 백신의 개발 단계부터 상용화에 이르기까지 필요한 모든 기술을 한 개의 기업이 보유하는 것은 현실적으로 어렵기 때문에 기술 라이선스 등 여러 기업과의 협업이 매우 중요하다.”고 언급했다.
2022년 일본 정부는 바이오 의약품 개발 생산에 대한 구체적인 지원 방향을 제시해 향후 일본 국내에서 예방∙치료용 백신의 확충 및 접종 선택권 확대 등을 실현할 수 있도록 민간 기업을 대상으로 백신 개발 인센티브와 경제적 지원 등을 국가 정책으로 추진하고 있다.
인류의 건강을 위해 한국의 제약회사나 기업이 일본의 다양한 이해관계자들과 협력해 가면서 백신에 관한 획기적인 기술 창조와 개발을 통해 경쟁력 확보와 시장 확대에 더욱 기여하길 바란다.
자료원: 일본 후생노동성, 일본제약공업협회, 의약산업정책연구소, 후지경제, 노무라종합연구소, 관세청, K-stat 및 KOTRA 도쿄 무역관 자료 종합
<저작권자 : ⓒ KOTRA & KOTRA 해외시장뉴스>
- 이전글 러시아 의약품 시장 동향
- 다음글 중국 바이오의약 산업 발전 가속화

















