의약품 관련 법령
말기환자들의 개발 중 의약품(Experimental drugs) 접근 법안, 미국 하원 통과
| 작성자 | 관리자 | ||
|---|---|---|---|
| 작성일 | 2018-04-12 | 조회수 | 2,360 |
| 국가정보 | 북 아메리카>미국 | ||
| 출처 | 생명공학정책연구센터 | ||
| 원문 | http://www.bioin.or.kr/board.do?num=278451&cmd=view&bid=issue&cPage=1&cate1=all&cate2=all2 | ||
BioINwatch(BioIN+Issue+Watch): 18-28
말기환자들의 개발 중 의약품(Experimental drugs) 접근 법안, 미국 하원 통과
◇ 미국 연방의회 하원은 말기환자들이 FDA의 승인을 받지 않은 의약품, 즉 임상단계 중인 의약품(Experimental drugs)에 대한 접근을 요청할 수 있게 하는 법안 ‘시도할 권리(Right to try)’을 승인. 동 법안은 지난해 상원에서 만장일치로 통과하였으며, 도널드 트럼프 대통령은 1월 연두교서에서 이를 지지한 바 있음
▸주요 출처 : The New York Times, House Passes Bill That Would Give Patients Access to Experimental Drugs, 2018.3.21.; Nature, Seven days - Experimental drugs, 2018.3.22.; 국가생명윤리정책원, 미국 말기환자의 임상시험 약물 사용 요구 ‘시도할 권리 (Right to try)’ 법제화 추진, 2017.3.24
■ 말기환자들이 임상단계에 있는 의약품에 접근할 수 있는 ‘시도할 권리(Right to try)’ 법안이 미국 하원에서 통과(2018.8.3)
○ 미국 연방의회 상원은 S.204(Trickett Wendler, Frank Mongiello, Jordan McLinn, and Matthew Bellina Right to Try Act of 2017) 법안을 만장일치로 승인(2017.8)
- 이 법안은 승인된 치료법에 효과가 없고 신약 관련 임상시험에 참가할 수 없는 말기환자들을 대상으로 임상시험 중인 의약품의 사용을 허용하자는 내용
※ 이러한 치료의 제조자, 분배자, 처방자, 조제자, 소지자 또는 사용자는 치료와 관련하여 어떠한 책임도 지지 않으며, 이러한 치료의 제조, 분배, 처방, 조제, 소지 또는 사용의 결과는 연방기관에 의해 치료의 검토 및 승인에 악영향을 주기 위해 사용될 수 없음
- 동 법안에서 허용하는 치료제 조건은 ① 임상 1상(초기, 소규모) 임상시험을 성공적으로 완료, ② FDA의 승인받은 임상시험에서 연구를 지속, ③ 연방 식품의약품화장품법(Federal Food, Drug, or Cosmetic Act) 또는 공중보건법 (Public Health Service Act)에 따라 승인, 허가 또는 판매허가를 받지 않은 것
○ 미국 공화당은 시도할 권리(Right-to-try)의 입법화를 추진하고 있으며, 트럼프 대통령이 올 1월 연두교서에서 시도할 권리를 지지해달라고 의회에 요청한 이후 적극 추진
- 현재 시도할 권리(Right to try) 법안은 33개 주에서 시행되고 있으며, 나머지 17개 주에서도 상당한 호응을 받고 있음
- 향후 의회 통과를 거쳐 대통령 서명을 받으면 전국적으로 합법화될 예정
○ S.204와 유사한 법안인 H.R.5247(Trickett Wendler, Frank Mongiello, Jordan McLinn, and Matthew Bellina Right to Try Act of 2018)이 지난 3월 21일 미국 하원에서 찬성 267, 반대 149로 2/3의 찬성으로 법안이 통과
※ 동 법안은 수개월 이내에 사망할 가능성이 있는 질병 또는 상태로의 단계로 진단받은 환자의 임상시험 약물 사용을 허가하가나 다른 용도로의 사용을 허가
< 115회 미국 연방의회 - H.R.5247 개요 및 진행 사항 >
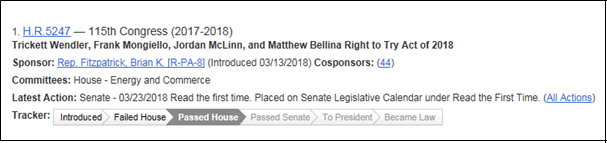
출처: https://www.congress.gov/bill/115th-congress/house-bill/5247/text
■ 환자 권익단체 및 일부 의료단체 등은 이 법안이 환자들에게 헛된 희망을 주며, 위험에 빠뜨리게 될 것이라고 우려를 표명
○ 다수의 환자 권익단체들은 말기환자의 치료받을 권리를 강조
- 임상시험 중의 약물은 안전성과 효능 면에서 안정적인 데이터가 없어 오히려 환자에게 더 나쁜 영향을 줄 수 있으며, 필사적인 환자들에게 거짓된 희망을 줄 수 있다고 경고
※ 뉴저지 주 Frank Pallone Jr. 위원은 FDA 검토를 배제하는 이 법안이 통과되면 환자가 위험에 처하게 될 것이며, 이는 FDA의 임상시험 관리에 전례 없는 시도로 FDA의 환자보호 능력을 약화시킬 것이라고 말함
○ 규제당국(FDA)의 개입 없이 의사와 환자, 의약품 제조업체가 개발 중인 약물 사용에 대한 합의가 이뤄지면 적용할 수 있는 시스템으로, 이는 전체 신약개발 시스템에 악영향을 줄 것으로 우려
○ FDA는 이미 의사가 심각한 질병이나 상태를 가진 환자에게 개발 중인 의약품을 시도할 수 있는 프로그램을 보유하고 있으며, 대부분의 요청이 승인된 상황으로 동 법안이 불필요하다는 의견도 제기
- FDA는 이 프로그램에 따라 접수된 요청의 99%를 불과 몇 시간 이내에 승인해주는 것으로 조사
- 이전글 「의약품동등성시험기준」(식약처 고시) 일부개정 알림
- 다음글 대한민국약전








