발간보고서
home > 자료실> 발간보고서
- 글자크기
해외 주요국 의약품 규제 동향 정보집 (제5호) - 미국
| 작성자 | 관리자 | 카테고리 | 기타 |
|---|---|---|---|
| 작성일 | 2022-07-18 | 조회수 | 404 |
| 원문 | https://www.bioin.or.kr/board.do?num=317377&cmd=view&bid=system&cPage=1&cate1=all&cate2=all2&s_str= | ||
| 출처 | 식품의약품안전평가원 | ||
해외 주요국 의약품 규제 동향 정보집 (제5호) - 미국
◈ 목차
기획 원고
의약품 품질 현황과 품질 향상을 위한 FDA 동향
임산부와 수유부의 의약품 임상연구 참여 확대를 위한 FDA 동향
신약개발 소요기간 현황과 관련 요인
동향 단신
새로운 첨가제 심사 파일럿 프로그램 시행
희귀의약품 규정 관련 유전자치료제의 동일성(sameness)에 관한 가이던스 발표
의약품 허가 외 사용 관련 '의도된 사용(intended use)' 판단에 관한 최종 규정 발표
코로나19 중 임상시험 시행의 고려사항에 대한 가이던스 발표
코로나19 중 제네릭 의약품 개발 및 허가신청에 대한 가이던스 발표
코로나19 백신의 부스터샷 긴극사용승인 현황과 향후 계획
의약품 광고가 소비자와 의료인의 인식에 미치는 영향에 대한 연구 공개
3D 세포 배양을 약물 개발 도구로 활용하기 위한 연구 진행사항 공개
연속 제조 공정에서 단백질 의약품의 바이러스 안전성 확보를 위한 노력
소아 의약품 개발 및 급성 심정지 예방을 위한 소아 심전도 데이터 웨어하우스 구축
바륨 조영제의 분류 변경: 의약품에서 의료기기로 변경
2021년 상반기 FDA 신약 허가의 특성 분석
FDA 신약 심사의 평가 연구 결과: 경계역의 유효성 근거 제품
관련 가이드라인 등
FDA Guidance (2021.8.~2021.10.)
MAPP (2021.8~2021.10.)
◈본문
의약품 품질 현황과 품질 향상을 위한 FDA 동향
|
- FDA는 2020년 의약품 품질 평가가 결과를 종합하여 품질 문제의 유형과 특성, 리콜 제품의 주요 약효군, 실사(inspection) 결과 및 관련 요인 등을 공개함 ‐ FDA는 의약품 제조 기반을 강화하기 위하여 첨단제조(advanced manufacturing)를 촉진하고 있으며, 이를 지원하기 위한 유망기술프로그램(Emerging Technology Program)을 가동하고 있음 ‐ 또한 의약품 공급 불안정 해소 및 품질관리 강화를 위해 의약품 품질에 관한 데이터 수집을 표준화하고, 데이터를 통해 품질 평가의 효율을 높이고자 함 |
1. 서론
■ 의약품 품질은 제품의 모든 용량(dose)이 안전하고 효과가 있으며 오염이나 결함이 없도록 보장하는 것을 의미함
• 의약품 품질 문제는 위해(harm) 발생, 의약품 공급 중단, 규제 당국에 대한 신뢰 문제로 이어질 수 있음. 즉 의약품 품질은 규제 정책과 기술의 핵심적인 우선 분야가 되어 왔음
• 코로나19 유행은 글로벌 의약품 공급 체인의 불안정을 촉진하였고 규제 당국의 의약품 품질 관리를 어렵게 하였음. 이는 결과적으로 품질이 보장된 의약품의 안정적 제조, 공급 체계의 필요성을 더욱 부각하였음
■ 이 글에서는 FDA의 의약품 품질 관리 조직, 2020년 의약품 품질 현황, 의약품 품질 향상을 위한 FDA의 정책 현황을 살펴보고자 함
• 2020년 의약품 품질 현황은 「2020년 의약품 품질 현황 보고서(Report on the state of pharmaceutical quality: fiscal year 2020)」(2021. 8)를 바탕으로 작성하였고, 품질 향상을 위한 FDA의 정책과 프로그램은 의약품평가연구센터(Center for Drug Evaluation and Research, 이하 CDER) 내 의약품 품질부서(Office of Pharmaceutical Quality, OPQ)의 「2020년 연례보고서(2020 Annual report)」의 내용을 중심으로 작성함
2. FDA의 의약품 품질 관련 조직
■ FDA는 CDER 산하에 의약품 품질부서(Office of Pharmaceutical Quality, OPQ)를 설치하고 의약품의 품질 관리 업무를 총괄하게 함
• 의약품 품질부서(OPQ)는 의약품 품질의 글로벌 표준을 지향하며 다음의 업무 수행을 목표로 함
|
의약품 품질부서(OPQ)의 목표 - 모든 인체용 의약품이 임상적 효과를 고려한 동일한 품질 기준을 충족하도록 보장 - 과학에 근거하고 위험을 고려한 규제적 접근을 촉진 - 의약품 품질의 감독을 질적 평가에서 품질 평가의 시스템화(Quality Platform or Quality Metrics)를 통한 양적 평가, 전문가에 의한 평가로 전환 - 심사, 실사(inspection), 시판 후 감시, 정책, 연구에 이르기까지 제품의 전주기에 걸쳐 원활한 품질 관리 - 의약품 제조의 유망기술(Emerging pharmaceutical technology)의 개발과 도입을 장려 |
• 의약품 품질부서(OPQ) 하에 8개의 하부 조직(sub-office)을 두고 있음
[그림 1] 의약품 품질부서(Office of Pharmaceutical Quality) 조직도
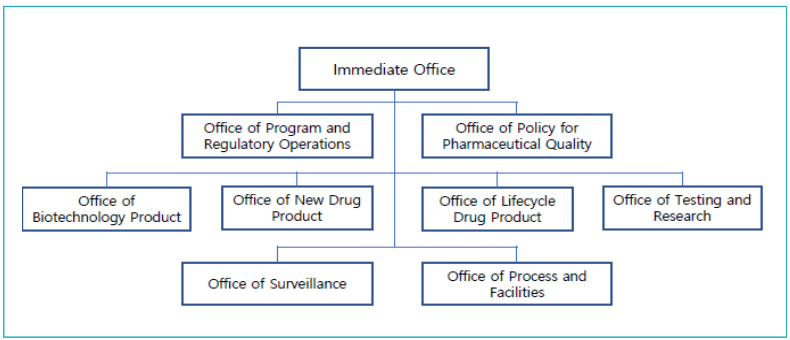
자료: FDA. FDA Pharmaceutical Quality Oversight. p. 2.
...................(계속)
☞ 자세한 내용은 내용바로가기 또는 첨부파일을 이용하시기 바랍니다.








