공지사항
home > 소식> 공지사항
- 글자크기
유전자, 세포 및 RNA치료제 개발 활기
| 작성자 | 관리자 | ||
|---|---|---|---|
| 작성일 | 2021-05-24 | 조회수 | 2,074 |
| 출처 | 바이오인 | ||
| 원문 | https://www.bioin.or.kr/board.do?num=307290&cmd=view&bid=issue&cPage=1&cate1=all&cate2=all2 | ||
BioINwatch(BioIN+Issue+Watch): 21-34
유전자, 세포 및 RNA치료제 개발 활기
◇ 유전자, 세포 및 RNA 치료제의 새로운 임상시험이 지난 4년 전인 2016년에 비해 2020년 3배 가까이 증가. 주로 암을 타겟으로 개발되고 있으며, 특히 유전자치료제 개발이 활발. 유전자, 세포 및 RNA치료제 기업 및 스타트업에 대한 투자자들의 관심이 증가하면서 올 1분기 약 4.8억 달러가 스타트업에 투자
▸주요 출처 : Science, Gene and cellular therapy trials take off, 2021.4.30.; American Society of Gene & Cell Therapy(ASGCT), Gene, Cell, & RNA Therapy Landscape – Q1 2021 Quarterly Data Report, 2021.4.15.; Informa Pharma Intelligence, A Peek At The Hand Of Cell, Gene And RNA Therapies, 2021.5.5.
▣ CAR-T 성공을 계기로 세포·유전자치료제 개발이 매우 활발해지는 추세이며, 최근 코로나19 백신을 통해 RNA치료제 가능성 입증
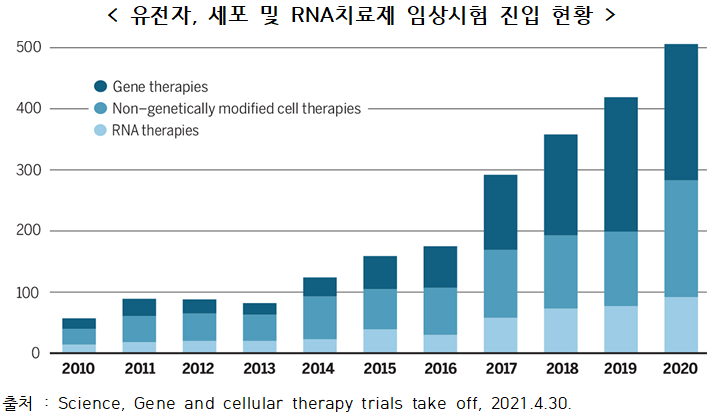
○ 유전자, 세포 및 RNA 치료제의 새로운 임상시험이 지난 4년 전인 2016년에 비해 2020년 3배 가까이 증가
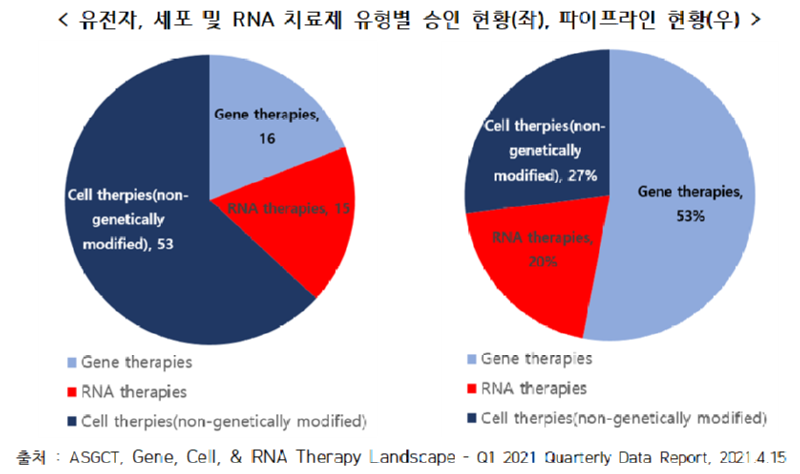
○ 현재 전세계적으로 승인된 유전자치료제(유전자변형 세포치료제 포함)는 16개, RNA치료제 15개, 세포치료제(유전자 비변형)는 53개로 총 84개
- 최초의 유전자치료제는 2004년 중국의 Shenzhen SiBiono Gene Tech에서 개발한 Genedicine이 중국에서 승인되었지만,
- 안전성 이슈*로 주요국의 개발이 주춤하다가 2015년 Amgen에서 개발한 Imlygic이 미국과 유럽에서 승인되면서 주요국의 유전자치료제 개발 활발
* 1999년 유전자치료 임상시험에 자원한 제시 겔싱거(Jesse Gelsinger)라는 OTC (Ornithine transcarbamylase deficiency) 결핍증 환자가 미국 펜실베이니아 의대에서 아데노바이러스를 이용한 유전자치료를 받고 나서 전신 면역반응으로 사망
- RNA치료제는 IONIS Pharmaceuticals사가 개발한 Kynamro*의 2013년 미국 FDA 승인을 시작으로, 지난해 승인된 Moderna Therapeutics사의 코로나19 백신 등 RNA치료제에 대한 관심 고조
* 가족성 고-콜레스테롤혈증 질환자의 아포지질단백질 B-100 합성을 억제하는 ASO (Anti-sense oligonucleotide) 기전의 RNA치료제
- 유전자가 변형되지 않은 순수 세포치료제는 안전성이 인정되어 가장 많은 치료제가 승인된 상황
○ 세포치료제가 50% 이상이었던 승인 현황과 달리 현재 개발 중인 파이프라인(비임상부터 등록전 상태)은 유전자치료제가 50% 이상을 차지
- 2021년 1분기 기준 3,474개의 파이프라인에서 유전자치료제 또는 CAR-T와 같이 유전자가 변형된 세포치료제가 파이프라인의 53%를 구성
▣ 유전자 치료제 파이프라인 현황
○ 유전자변형 세포치료제를 포함한 유전자치료제 파이프라인은 2014년 이후 급격히 증가, 2020년 1,300개 이상이 파이프라인에 있음
- 이 중 69%(912개)가 전임상 단계에 있으며, 25개가 임상 3단계에 있음








