![]()
 연구중심병원 지정기관
연구중심병원 지정기관 세브란스병원
세브란스병원 주요기술
주요기술
주요기술
암의 기원 세포의 사멸용 약학적 조성물
개발자
강석구 교수(의과대학 신경외과학교실)
기술설명
본 기술은 페르페나진(perphenazine)과, 바이구아나이드(biguanide)계 화합물 및 글루코스 흡수 억제제(glucose uptake inhibitor)를 유효 성분으로 포함하는 암의 기원 세포의 사멸용 약학적 조성물로, 본 약학적 조성물을 통해서는 암의 기원 세포를 특이적으로 사멸시켜 암을 효과적으로 개선 또는 치료할 수 있을 뿐만 아니라, 더 나아가서는 암의 발병 자체를 예방하거나, 암의 재발 또한 예방할 수 있다.
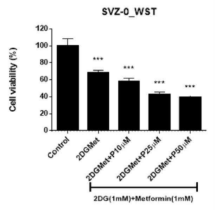
Fig) 교모세포종의 기원 세포인 뇌실하 영역 세포 (SVZ)에 본 발명의 화합물을 병용하여 처리한 후, 세포생존율의 변화를 나타낸 그래프
활용성
신경교종(glioma)은 원발성 뇌 종양(primary brain tumor)의 60%를 차지하는 종양으로, 발생빈도가 높고 치료가 어려워 현재까지도 방사선치료 외엔 특별한 치료법이 없는 악성 종양에 해당하며, 그 중 가장 악성으로 분류되고 있는 교모세포종(glioblastoma, GBM)의 경우 일단 진단되면 생존기간이 1년에 불과하다. 또한 뇌종양 치료제의 세계시장 규모는 2020년 약 23억 달러에서 연평균 10.4% 성장을 통해 2028년 약 56억 달러로 확대될 것으로 전망된다.
최근 상기 교모세포종의 기원 세포가 뇌실하 영역의 세포와 뇌실하 영역으로부터 이동한 세포에 해당한 것이 밝혀진 바 있다. 따라서 교모세포종의 효과적인 치료를 위하여서는, 발생기원에 대한 초기 진단과 이해 및 그에 기반한 새로운 치료법을 개발하여야 할 필요성이 요구되고 있기 때문에, 본 기술을 통해 효과적인 교모세포종 치료가 가능해 질 것으로 사료된다.
피부-특이적 T 세포(skin-specific T cell)의 억제제를 유효성분으로 포함하는 아토피피부염의 예방 또는 치료용 조성물
개발자
박창욱 교수(의과대학 피부과학교실)
기술설명
본 발명은 염증 또는 자가면역성 피부질환의 예방 또는 치료용 조성물에 관한 것으로, 피부-특이적 T 세포(skin-specificT cell)의 활성을 특이적으로 억제함으로써 전신적인 면역 활성에 대한 영향을 최소화하면서도 염증으로 인한 피부 조직 손상을 효율적으로 개선할 수 있는 근원적인 치료 조성물로 유용하게 이용될 수 있다. 본 발명은 또한 피부-특이적 T 세포의 활성을 억제함으로써 피부 조직에 발생한 다양한 자가면역성, 염증성손상을 경감시킬 수 있는 유망한 치료제 후보물질을 높은 신뢰도로 신속하게 탐색할 수 있는 스크리닝 방법을 제공한다.
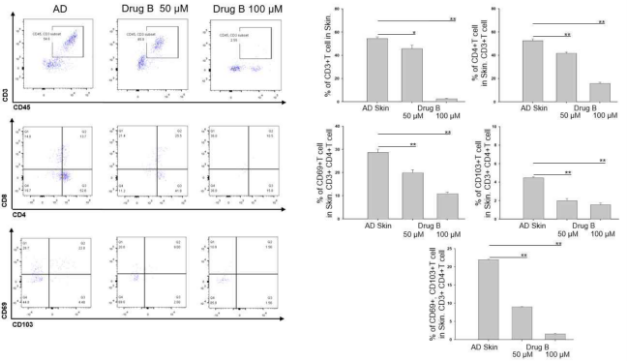
Fig) Drug B 처리에 따른 아토피피부염 환자의 피부에서의 T세포 분획을 비교한 결과를 보여주는 히스토그램
활용성
아토피피부염은 주로 연령, 중증도, 인종, Th2/Th17/Th22 반응과 같은 면역학적 이상, 피부 감염 여부 등에 따른 차이를 바탕으로 분류되고 있는데, 임상에서 아토피피부염의 다양한 표현형에 따라 개인별 맞춤형 치료를 적용하는 것은 아직 초기 단계이다. 기존의 치료 패러다임의 가장 큰 문제점은 아토피피부염이 피부에 발생하는 조직 특이적 질환임에도 불구 하고 전신적인 접근, 특히 혈액을 대상으로 면역 반응 및 염증 반응을 제어하려고 하는 개발 시도가 대부분이었다는 점이다. 이에, 아토피피부염의 신규 치료제 후보물질 탐색을 위해서는 피부-특이적 T 세포(skin-specific T cell)를 표적으로 하는 새로운 방식의 치료적 접근이 필요하지만 이러한 연구는 전 세계적으로 전혀 진행되고 있지 않다. 이러한 상황에서, 본 연구진은 피부조직 특이적인 염증 및 면역 반응 제어를 통해 피부 병변의 증상을 개선하는 효율적인 치료제 조성물을 개발하기 위하여 연구 하였고, 이를 통해 본 발명의 화합물이 혈청 총 IgE를 유의하게 감소시키고 피부-특이적 T 세포(skin-specific T cell)를 현저히 억제함으로써 전신적인 면역 활성에 대한 영향을 최소화하면서도 피부 병변을 유의하게 개선함을 발견하였다. 이에, 본 기술이 해당 분야에서 큰 수요가 있을 것으로 사료된다.
항암 면역치료제 반응성 예측방법
개발자
김재우 교수(의과대학 생화학·분자생물학교실)
기술설명
본 기술의 발명자는 면역치료제 반응성 예측을 위하여 연구 노력하였으며, 특히 예후가 가장 좋지 않고 효과적인 치료제의 발굴 및 진단이 어려운 줄기세포형 위암을 타겟으로 하여 면역치료제 반응성 예측방법 및 신뢰도 높은 진단법/치료제 개발을 위하여 연구 노력하였다. 그 결과, 난치성 암종에서 OOO의 발현이 높다는 사실 및 면역치료제를 주입하였을 때 면역치료제에 대한 저항성이 있다는 사실을 확인할 수 있었다. 또한, 암 시료에서 OOO의 발현량 변화를 측정함으로써 줄기세포형 위암과 같은 난치성 암의 진단 및 치료가 가능함을 발견함에 따라 본 발명을 완성하게 되었다.
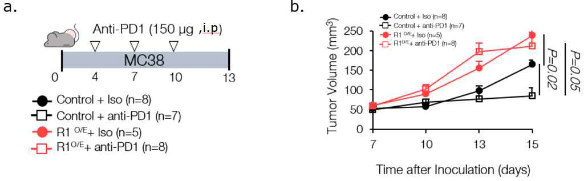
Fig) 생체 내 암 세포에 OOO 발현을 증가시킨 후 면역항암제를 투여했을 때 생체 내 종양크기 변화
활용성
아토피피부염은 주로 연령, 중증도, 인종, Th2/Th17/Th22 반응과 같은 면역학적 이상, 피부 감염 여부 등에 따른 차이를 바탕으로 분류되고 있는데, 임상에서 아토피피부염의 다양한 표현형에 따라 개인별 맞춤형 치료를 적용하는 것은 아직 초기 단계이다. 기존의 치료 패러다임의 가장 큰 문제점은 아토피피부염이 피부에 발생하는 조직 특이적 질환임에도 불구 하고 전신적인 접근, 특히 혈액을 대상으로 면역 반응 및 염증 반응을 제어하려고 하는 개발 시도가 대부분이었다는 점이다. 이에, 아토피피부염의 신규 치료제 후보물질 탐색을 위해서는 피부-특이적 T 세포(skin-specific T cell)를 표적으로 하는 새로운 방식의 치료적 접근이 필요하지만 이러한 연구는 전 세계적으로 전혀 진행되고 있지 않다. 이러한 상황에서, 본 연구진은 피부조직 특이적인 염증 및 면역 반응 제어를 통해 피부 병변의 증상을 개선하는 효율적인 치료제 조성물을 개발하기 위하여 연구 하였고, 이를 통해 본 발명의 화합물이 혈청 총 IgE를 유의하게 감소시키고 피부-특이적 T 세포(skin-specific T cell)를 현저히 억제함으로써 전신적인 면역 활성에 대한 영향을 최소화하면서도 피부 병변을 유의하게 개선함을 발견하였다. 이에, 본 기술이 해당 분야에서 큰 수요가 있을 것으로 사료된다.
불일치 복구 유전자 기능 결핍 환자에서 환자 유래 오가노이드를 이용한 개인별 DNA 손상 반응 평가 및 암 위험도 예측
개발자
김태일 교수(의과대학 내과학교실)
기술설명
본 발명은 린치 증후군 환자를 포함한 불일치 복구 유전자 기능 결핍 환자 유래의 대장 오가노이드를 이용한, 불일치 복구 유전자 기능 결핍 환자의 개인별 DNA 손상 반응 평가 또는 대장암 발병 위험도 예측 방법에 관한 것으로, 보다 상세하게는 불일치 복구 유전자 기능 결핍 환자 유래 대장 오가노이드의 제조 및 상기 대장 오가노이드에 OOO를 병용처리하는 방법이다.
본 발명의 목적은 MMR 유전자 기능 결핍 환자의 대장암 발병 위험도 예측을 위한 대장 오가노이드와 이의 제조 및 처리 방법을 제공하는 것이다. 또 다른 목적으로는 MMR 유전자 기능 결핍 환자 유래의 대장 오가노이드를 이용한, 불일치 복구 유전자 기능 결핍 환자의 개인별 DNA 손상 반응 평가 또는 대장암 발병위험도 예측을 위한 정보를 제공하는 것이다. 이때, MMR 유전자 기능 결핍 환자는 린치 증후군 환자일 수 있다.
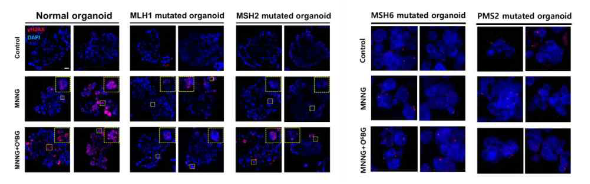
Fig) LS-PDO에서 OOO 처리 후 γH2AX의 발현을 확인한 것
활용성
대부분의 린치 증후군 환자는 유전적으로 MMR 유전자의 하나의 대립 유전자에 돌연변이를 가지고 있다. 그러나, 린치 증후군 환자의 30%는 불확실한 유의성(variant of uncertain significance, VUS)의 변이를 가진다. 이는 유전자 검사를 통해 확인된 유전적 변이로, 유기체의 기능이나 건강에 미치는 중요성은 아직 알려지지 않았다. 이는 개인의 암 위험에 대한 영향이 아직 알려지지 않았음을 의미한다. 따라서, VUS의 MMR 유전자 변이 보인자와 그 들의 인척에 대한 린치 증후군 진단은 만족스러운 유의성의 결여로 인해 불가능하기 때문에, VUS는 암 발생 위험도 예측의 주요 임상 과제이다. MMR 유전자의 생물학적 중요성과 관련하여, 일부 연구자들은 다양한 실험 시스템에서 기능적 분석을 보여주었으나, 대부분은 박테리아 효모, 마우스를 기반으로 개발되어 본질적 한계가 있다. 위와 같은 배경 하에, 본 발명자들은 린치 증후군을 포함한 MMR 유전자 기능 결핍 환자 유래의 대장 오가노이드 에 세포 독성 차이를 최대화한 후, 세포사멸 또는 γH2AX 발현 수준을 확인함으로써 DNA 손상 반응의 조기 검출 을 통해 개별 린치 증후군 환자 또는 MMR 유전자 기능 결핍 환자의 대장암 발병 위험도의 예측 가능성을 확인 하고 본 발명을 완성하였다.
안구건조증 또는 안구건조증 연관 안과 질환의 예방, 개선 또는 치료용 조성물
개발자
김태임 교수(의과대학 안과학교실)
기술설명
본 발명은 안구건조증 또는 안구건조증 연관 안과 질환의 예방, 개선 또는 치료용 조성물에 관한 것으로써, 본 발명에서는 PKA(protein kinase A) 세포신호전달체계를 활성화하여 마이 봄샘 기능 장애에서 발생될 수 있는 지질 합성 저하를 효과적으로 개선하여, 마이봄샘에서 분비된 지질이 안구 표면 수분 증발을 줄여 안구건조증 또는 안구건조증 연관 안과 질환을 예방, 개선 또는 치료할 수 있다.
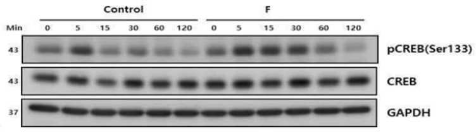
Fig) HMGEC 세포주에서 PKA(Protein kinase A) 활성화 확인을 위한 CREB 단백질의 인산화를 면역 블롯팅을 통해 확인한 결과
활용성
안구건조증의 가장 보편적인 대처는 인공누액을 이용하여 모자라는 눈물 성분을 공급해 주는 것으로, 용액, 연고, 묽은 젤리 형태 등 다양한 종류가 있다. 그러나, 인공누액을 이용하는 방법은 안구건조증 증상을 일시적으로 개선하는 효능이 있을 뿐, 안구건조증의 진행을 억제하여 증상을 근원적으로 완화 하기에는 역부족하다.
한편, 마이봄샘(meibomian gland, MG)은 상부 및 하부 눈꺼풀판 내부에 위치한 변형된 피지선으로, 수성층을 코팅하고, 안구 표면을 매끄럽게 할 뿐만 아니라, 외인성 물질로부터 눈을 보호하는 등의 역할을 수행한다. 특히, 마이봄샘이 제대로 기능하게 되면, 마이봄샘에서 분비된 지질이 안구 표면 수분 증발을 줄이고, 안구 건조를 예방할 수 있다. 이와 같은 마이봄샘의 기능 장애가 유발되는 경우 환자의 삶의 질에 영향을 미칠 수 있는 안구 불편감, 통증, 결막 충혈, 시력 저하 및 안구건조 등의 증상이 발생 될 수 있다.
이에, 마이봄샘 기능 장애를 개선하여 안구건조증을 예방 또는 치료할 수 있는 약물의 개발이 필요한 시점이다. 본 발명은 이러한 실정에서 마이봄샘의 장애를 개선할 수 있는 조성물을 제공하여 관련 분야에서 널리 활용될 수 있을 것으로 사료된다.
저분화 화합물의 조합을 유효성분으로 포함하는 뇌종양의 예방 또는 치료용 조성물
개발자
하윤 교수(의과대학 신경외과학교실)
기술설명
발명자들은 암세포, 특히 신경교모세포종을 비롯한 뇌종양 조직 내 암세포의 증식을 낮은 용량에서도 유의하게 억제하는 효율적인 항암 조성물을 개발하기 위해 연구 노력하였다. 그 결과, 피라졸일 벤즈아마이드 유도체 화합물과 cAMP의 활성화제를 병용 투여할 경우, 현저한 상승효과가 발생하여 저용량에서도 암세포의 성장을 선택적으로 억제할 뿐 아니라, 악성의 신경교모세포종을 양성의 신경세포로 직접 전환시킴으로써 종양의 제거 및 소실된 세포의 양적 복구를 동시에 달성하여 손상된 신경 조직을 가역적으로 회복시킬 수 있음을 발견함으로써, 본 발명을 완성하였다.
본 발명은 암, 구체적으로는 뇌종양, 보다 구체적으로는 신경교모세포종에 대한 예방 또는 치료용 조성물에 관한 것이다. 본 발명은 피라졸일 벤즈아마이드 유도체 화합물과 cAMP의 활성화제의 병용 투여를 통해, 단독 투여 시 에는 유의한 항암 활성이 측정되지 않을 정도의 저용량으로도 현저한 암세포 증식 억제 효과를 보인다. 이에, 본 발명의 조성물은 내성이나 부작용 없이 저용량의 장기 투여가 가능한 효율적 항암 조성물로 이용될 수 있다. 본 발명은 또한, 악성의 신경교모세포종을 양성의 신경세포로 직접 전환시켜 종양의 제거 및 소실된 세포의 양적 복구를 동시에 달성함으로써, 종래의 대증적 치료에서 벗어나 종양으로 손상된 신경 조직을 가역적으로 회복시 키는 근원적 치료제 조성물로 이용될 수 있다.
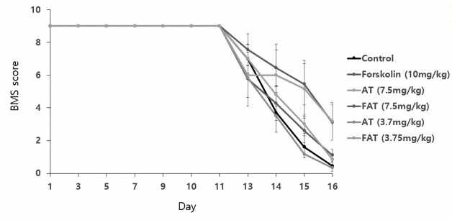
Fig) 본 발명의 조성물에 의한 Balb/c 누드마우스에서의 신경교종세포 성장 억제효과를 보여주는 그림
활용성
현재까지 교모세포종에 대한 치료 전략은 일반적인 뇌종양 치료 전략과 같이 외과적 수술, 방사선 요법 및 항암제 요법이 적용되고 있으나, 다형성 신경교모세포종의 특유의 복잡한 발병 기전과 복합적인 약물 내성으로 인해 환자의 생존성을 거의 개선하지 못하고 있다. 이에, 교모세포종을 제거하거나 정상 세포로 전환함으로써 악성 세포를 근원 적으로 제거, 환자의 생존성을 현실적으로 개선시킬 수 있는 유효한 뇌종양 치료전략의 수립이 요구되고 있다.
본 발명은 이러한 요구를 신경교모세포종을 양성의 신경세포로 전환시키켜 종양의 제거 및 소실된 세포의 양적 복구를 동시에 달성하는 성과를 통해 충족시키고 있다. 또한, 이를 통해 종래의 대증적 치료에서 벗어나 종양으로 손상된 신경 조직을 가역적으로 회복시키는 근원적 치료제 조성물로 이용될 수 있다.
내시경 피펫 및 관찰 시스템
개발자
김백길 교수(의과대학 병리학교실)
기술설명
본 기술은 가시적으로 확인이 어려운 배양용기 내부의 스페로이드 상태를 확인하면서도 배지를 추출 하는 과정에서 스페로이드의 움직임을 함께 감지하여 스페로이드를 분실하는 사태를 방지하도록 피 펫 팁과 일정한 각도를 갖도록 카메라모듈이 구비되는 것을 특징으로 한다. 더 나아가, 스텝모터를 활용하여 내시경 카메라를 원하는 거리 혹은 간격으로 이동시키며 영상을 모니터로 전송하여 관찰을 용이하게 하고, 내시경 카메라의 움직임 범위를 효과적으로 향상시키기 위한 세밀한 조정이 가능하다.
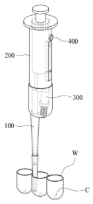
Fig1) 내시경 피펫 및 관찰 시스템 관찰장치의 전반적인 구성을 설명하기 위해 도시한 도면
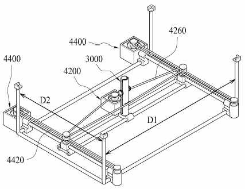
Fig2) 스페로이드 관찰장치 및 시스템의 전반적인 구성을 설명하기 위해 도시한 도면
활용성
<with research korea, 2022.08.31.일 뉴스 발췌> 제시된 것과 같이 2016년도부터 피펫의 시장 규모는 꾸준히 증가하고 있는 추세를 기록하고 있으며, 2019년도에 covid-19에 대한 치료제 연구를 위한 것으로 분석되었고, 이를 바탕으로 백신의 개발과정에서 피펫의 사용이 필수적 이라고 생각할 수 있다. 아울러 스페로이드의 배양에서는 배지의 추출과 주입과정이 필수적으로 수반되며, 이 과정에서 스페 로이드가 배지의 유속에 따라 피펫 안쪽으로 흡입되어 버려 소실되는 사태를 카메라 모듈을 통해 효과적으로 방지할 수 있으므로 사업상 활용도가 상당히 높다고 사료된다.
심혈관 질환과 관련된 LncRNA 및 이의 용도
개발자
이상학 교수(의과대학 내과학교실)
기술설명
본 기술의 발명자들은 관상동맥질환을 비롯한 심뇌혈관 질환의 위험성을 정확히 예측할 수 있는 유효한 RNA 바이오마커를 발굴하고, 병의 발생위험을 높이는 기전을 파악하며, 치료에 적용하기 위해 노력 하였다. 1) 그 결과, 특정 LncRNA (Long non-coding RNA) HSPA7이 인체 혈관 죽상경화반에서 특이 적으로 고발현됨을 확인하였다. 2) 또한 이의 발현에 의해 인간 대동맥 평활근 세포의 이동이 촉진되 고 염증인자 발현이 증가되어 심뇌혈관질환을 유발하는 동맥경화가 촉진됨을 발견하였다. 3) 한편 miR-223 억제상태에서 NFkB 경로와 염증성 싸이토카인이 활성화되는데 HSPA7을 억제하면 이런 효과가 저하됨을 확인하여, HSPA7와 miR-223의 상호작용이 중요하고, HSPA7 억제가 혈관질환 억제 타겟이 될 수 있음을 발견하였다. 4) 결론적으로 해당 LncRNA가 심뇌혈관 질환에 대한 신뢰도 높은 예측 및 진단 마커일뿐 아니라 유효한 치료 타겟임을 최초로 규명하였다.
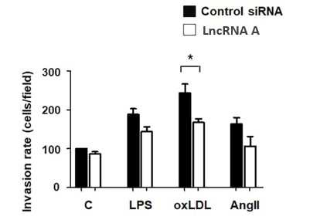
Fig) LncRNA의 녹다운이 HASMC 이동에 미치는 영향을 조사하기 위해, 세포에 해당 LncRNA 또는 대조군 siRNA를 24시간 동안 형질전환하고 LPS, oxLDL 또는 AngⅡ의 존재 또는 부재 하에 상부 챔버에 플레이팅한 결과. 24시간 뒤, 하부 챔버에서 oxLDL에 의해 촉진된 HASMC의 이동이 해당 LncRNA 처리 후 유의하게 억제됨을 확인함.
활용성
심뇌혈관 질환은 유병률이 높고, 국내에서도 관련 사망률이 증가하고 있는 대표적 위험질환이다. 또한 발병시 해당환자에게 치명적이기에 평소 위험 인자를 파악하여 적절한 예방, 예측, 및 관리가 필요하다.
본 발명은 LncRNA HSPA7의 영향과 작용경로를 구체적으로 밝혔으며, 이를 통해 동맥경화를 비롯한 심뇌혈관 질환의 발병 가능성을 높은 신뢰도로 예측할수 있는 중요한 정보를 제공할 수 있다. 아울러, 해당 LncRNA 발현 억제를 통해 평활근 세포의 이동을 저해하고 염증인자의 발현을 감소시켜 죽상경화반의 발생 및 진행 자체를 차단함으로써 항혈전제 투여와 같은 대중적 요법을 넘어서는 근원적인 치료제 조성물로 유용하게 이용될 수 있다.
심방세동 진단을 위한 엑소좀 내 긴 비암호화 RNA 바이오마커 및 이의 용도
개발자
정보영 교수 (의과대학 내과학교실)
기술설명
본 발명은 심방세동 환자의 혈청 엑소좀 내 긴 비암호화 RNA(lncRNA) 프로파일 분석 결과를 바탕으로 심방세동 진단용 lncRNA 바이오마커를 발굴한 것을 기반으로 한다. lncRNA는 다양한 질병에서 발현 양상이 다르므로, 비침습적 진단 바이오마커로써 의학계에서 활발히 연구되고 있다. 본 발명자들은 시료 로부터 엑소좀을 분리하여, RNA 시퀀싱을 통한 심방세동 바이오마커 후보 스크리닝, qRT-PCR을 통한 정상 대조군과의 차등적인 발현 확인, ROC 곡선 분석을 사용한 lncRNA 바이오마커의 심방세동과의 더욱 유의한 관계 확인, Pearson’s correlation coefficient, GO enrichment analysis를 통한 표적 유전자의 기능 확인 등을 통하여 심방세동 진단에 우수한 효과를 가진 바이오마커를 발굴하고 검증하였다.
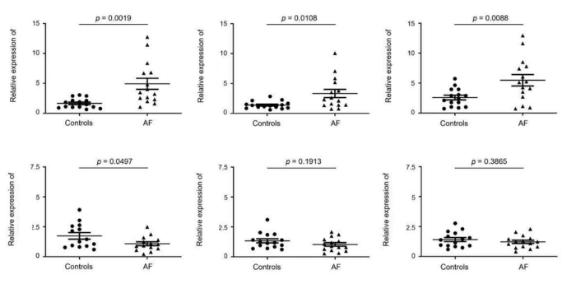
Fig) 혈청 엑소좀 내 lncRNA의 validation
활용성
심방세동(atrial fibrillation; AF)은 심장이 불규칙하게 뛰는 부정맥의 일종으로, 고령화 사회가 도래함에 따라 전 세계적으로 환자가 급증하고 있는 대표적인 심장질환이다. 심방세동은 증상이 없는 경우가 많으 면서도 사망, 뇌졸중, 심부전, 혈관성 치매 등 중증질환 발생 위험을 크게 높인다. 심방세동은 희귀성 질환이 아님에도 불구하고, 현재까지 근본적인 진단 및 치료 방법이 없어 미충족 의료수요가 매우 큰 실정이며, 이러한 중요성 때문에 심방세동을 조기에 높은 정확도로 진단하는 것이 필요한 상황이다.
상기와 같은 실정에서, 본 발명의 lncRNA는 심방세동 진단용 바이오마커로 최소 침습적으로 환자의 편의성 을 향상시키며, 유효하고 정확하게 심방세동을 진단 또는 예방할 수 있다는 장점이 있어, 관련 분야에서 크게 활용될 수 있을 것으로 기대된다.
흉부 사진 기반의 근감소증 탐지를 위한 머신 러닝 방법 및 시스템 그리고 근 감소증 탐지 방법 및 시스템
개발자
홍남기 교수(의과대학 내과학교실)
기술설명
본 기술은 흉부 사진 기반의 근감소증 탐지를 위한 머신러닝 방법 및 시스템 그리고 근감소증 탐지 방법 및 시스템으로써, 마이크로프로세서를 이용한 흉부 사진기반의 근감소증 탐지를 위한 머신러닝 방법은, 1) 학습 데이터로서 환자의 흉부사진, A, B 및 C, 연령, 성별, BMI(body mass index, 체중 질 량 지수) 및 근감소증 여부를 제공하는 단계, 2) 흉부 사진을 제1 입력값으로 하고, A, B 및 C를 제1 출력값으로서 1차 머신러닝하여 제1 인공지능 모델을 제공하는 단계, 및 3) 제1 출력값, 연령, 성별 및 BMI를 제2 입력값으로 하고, 근감소증 여부를 제2 출력값으로 하여 2차 머신 러닝하여 제2 인공 지능모델을 제공하는 단계를 포함한다.
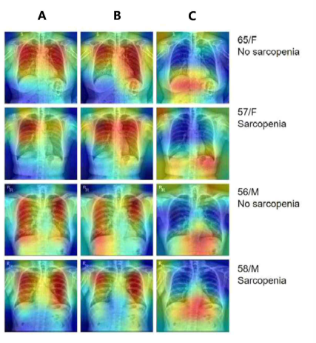
Fig) Grad CAM을 이용하여 코호트들의 흉부 방사선 사진에서 제1 인공지능 모델에서 출력된 A,B,C의 연관도를 나타낸 그래프
활용성
근감소증은 노화와 함께 근육의 양, 근력, 근 기능이 모두 감소하는 질환을 의미하며, 근감소증의 원인 은 개인마다 다르지만 근감소증은 단백질 섭취 저하 또는 운동량 부족에서 흔히 기인한다. 본 기술은 AI 모델을 통해 근감소증을 탐지하고자 한 기술이며, 의료 AI 진단의 세계 시장 규모는 2018년 21억 달러에서 연평균 50%의 성장을 통해 2025년 362억 달러로 확대될 것으로 전망된다.
근감소증은 일상적인 임상 실습 시 잘 감지되지 않는다. 흉부 방사선 촬영을 통하여 근감소증을 감지 하는 기술이 알려져 있으나 효과적이고 실용적인 기회주의적 선별 전략이 필요하다. 현재 흉부 방사선 촬영과 인공지능 기술을 함께 접목하여 근감소성을 탐지하고 있긴 하지만 그 유연성 부족으로 활용이 어렵다. 본 기술은 이러한 문제를 해결하기 위해 마이크로프로세서 머신러닝 시스템을 활용하여 근 감소성 탐지 방법을 제시하기 때문에 효과적인 근감소증 진단이 가능해 질 것으로 사료된다.


