의약품 관련 법령
주요 규제당국 신약 승인 심사기간 분석
| 작성자 | 관리자 | ||
|---|---|---|---|
| 작성일 | 2018-08-06 | 조회수 | 2,938 |
| 국가정보 | |||
| 출처 | BioIN | ||
| 원문 | http://www.bioin.or.kr/board.do?num=281006&cmd=view&bid=issue&cPage=1&cate1=all&cate2=all2 | ||
BioINwatch(BioIN+Issue+Watch): 18-55
주요 규제당국 신약 승인 심사기간 분석
◇ 영국 규제과학혁신센터(CIRS) 분석자료에 따르면, 다국적 기업의 전략 변화 (희귀의약품 개발) 및 제도마련(신속심사) 등으로 최근 10년(2008∼2017)간 신약 승인 심사기간이 크게 단축되었고, 승인된 신약 건수도 증가. 주요 6개(미국, 유럽, 캐나다, 일본, 스위스, 호주) 규제당국 중 미국 FDA의 신약 승인 심사기간이 평균 243일로 가장 빠른 것으로 조사
주요출처: CIRS(Centre for Innovation in Regulatory Science), New drug approvals in six major authorities 2008–2017 : Focus on the availability of medicines and company size, 2018.6
■ 주요 6개(미국, 유럽, 캐나다, 일본, 스위스, 호주) 규제당국의 신약 승인 심사기간은 미국 FDA가 평균 243일로 가장 빠른 것으로 조사
○ 영국 규제과학혁신센터(CIRS, Centre for Innovation in Regulatory Science)는 주요 6개 규제당국의 최근 10년간 신약(NAS, New Active Substance) 승인 심사기간을 분석, 점차적으로 단축되고 있는 추세로 조사
- 2017년 주요 6개국의 평균 심사기간은 미국 FDA가 243일로 가장 짧았으며, 일본 PMDA 333일, 캐나다 Health Canada 350일, 호주 TGA 364일, 유럽 EMA 419일, 스위스 Swissmedic 470일 순
※ FDA(Food and Drug Administration), PMDA(Pharmaceuticals and Medical Devices Agency), TGA(Therapeutic Goods Administration), EMA(European Medicines Agency)
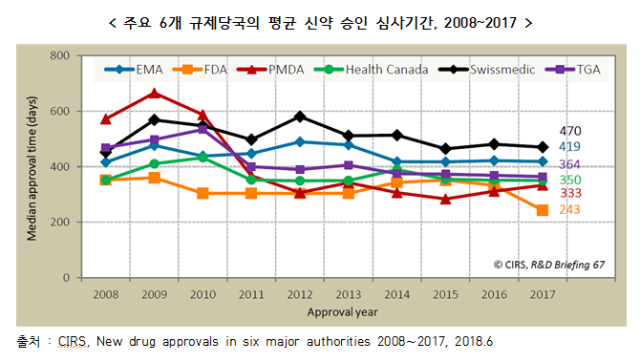
- 2014∼2016년에는 일본 PMDA의 신약 승인 심사기간이 가장 짧았으나, 2017년 미국 FDA가 이를 추월
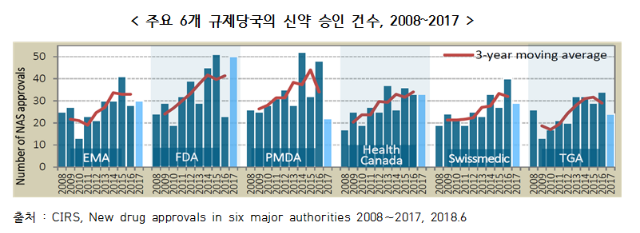
○ 6개 규제당국의 신약 승인 건수는 전반적으로 증가하고 있으며, 최근 5년(2013∼2017)간 빠르게 증가
- 2017년 FDA는 50개의 가장 많은 신약을 승인하였고, 그 뒤로 EMA 30건, Health Canada 30건, Swissmedic 29건, TGA 24건, PMDA 22건 순
○ 2008∼2012년과 2013∼2017년의 두개 구간으로 나누어 기관별로 승인된 신약 건수를 비교해보면, 호주의 TGA가 56%로 가장 큰 폭의 증가율을 기록
- 그 뒤로 Health Canada와 EMA가 46%, Swissmedic 41%, FDA 38%, PMDA 26%의 증가율을 보임
※ 각 규제기관별로 승인된 신약 건수의 국가별 차이는 여러 가지 요인으로 설명될 수 있음. 각 규제기관의 충족되지 않은 의약적 요구, 기관규모, 심사속도 등 전략에 따라 달라질 수 있으며, FDA와 같이 일년 내내 지속적으로 승인하는 곳이 있는 반면에 PMDA와 같이 일년 중 특정 시점에 승인업무를 수행하는 경우도 있음
...................(계속)
* 자세한 내용은 원문을 참고하시기 바랍니다.








