발간보고서
home > 자료실> 발간보고서
- 글자크기
중국 희귀의약품 시장 개발과 투자기회 분석
| 작성자 | 관리자 | 카테고리 | 전문가 인사이트 |
|---|---|---|---|
| 작성일 | 2019-02-18 | 조회수 | 4,193 |
| 원문 | 한국보건산업진흥원 | ||
| 출처 | |||

- 글 펑타오(Feng Tao)
- KHIDI 해외제약전문가 상임컨설턴트
- 2012.11∼2015.11 Novartis Pharmaceutical (China) Oncology, Associate Director
- 2010.11∼2012.11 Xian-Janssen Pharmaceutical Ltd, Senior Manager
- 2009.5∼2010.11 Allergan information Consulting(Shanghai)Co.,Ltd, National sales manager
- 2007.12∼2009.5 Xian-Janssen Pharmaceutical Ltd, Sales Region manager
- 2000.9∼2007.12 Bristol-Myers Squibb Company, Sales North Region manager
- 분야별 중국 시장 분석
- 중국 진출 전략 수립
- 최신 중국시장 흐름 및 정책 정보 제공
- 제품 선택
중국 희귀의약품 시장 개발과 투자기회 분석
희귀질환(Rare Disease)이란 발병률이 극히 낮고, 환자의 수가 적은 질병 또는 병변이다. 이를 치료하기 위해서 어려움도 많고 치료 수단도 극히 제한적이다. 희귀질환에 사용하는 약이란 이 같은 질병을 치료, 진단, 예방하기 위한 의약품으로, 약물, 백신, 진단 시약에 등을 포함하여 희귀의약품(Orphan Drug)이라고 부른다. 오늘날 개발된 7,000여 종의 희귀의약품 가운데 1%만이 희귀 질환 원인에 대해 효과를 보인다. 그러나 가격은 비싸기만 하여 환자에게 혜택을 받기란 어려운 일이다.
다음은 필자가 우선 심사의 ‘녹색통로’정책, 건강보험등재목록의 지급과 시장 개척 전략이라는 세 가지 측면에서 중국 희귀의약품 시장을 분석한 것이다. 부족하지만 많은 이들과 더 많은 의견을 나눌 수 있길 기대한다.
희귀의약품, 우선심사라는 ‘녹색 통로’를 걷게 되다.
특수의약품의 허가 시간을 단축하기 위해. 각 국가의 당국은 우선심사라는’녹색 통로’정책을 운용하고 있다. 중국도 의약품의 혁신력을 높이기 위해 최근 CFDA도 우선심사 제도를 도입하였다.
2017년 12월 28일 CFDA가 발표한 《의약품의 혁신을 독려하기 위한 우선심사 시행에 관한 의견(关于鼓励药品创新实行优先审评审批的意见)》수정본은 다시 한번 의약품의 우선심사 범위를 명확히 규정했다.
의약품의 우선심사 범위를 ‘분명한 임상적 가치를 가진 신약’, ‘임상 현장에서 시급한 제품’, ‘소아의약품’및 에이즈, 폐결핵, 바이러스성 간염, 희귀질환, 악성 종양, 노인 특발, 다발성 질환 등 특정 질병에 대한 약물로 규정했다.
희귀질환에 사용되는 의약품은 분명한 임상 가치가 있는 신약일 것
희귀질환의 대부분은 유전질환이 대부분이다. 병의 상태가 위중하더라도 치료 기전이 명확한 편에 속한다. 희귀질환을 치료하기 어렵지만, 맞춤형으로 치료에 개입하면 어느 정도의 결과를 얻을 수 있다. 고셔병, 페닐케톤뇨증 등 대사에 문제가 있는 경우가 이에 속한다. 다시 말해서, 희귀의약품은 분명한 임상적 가치를 쉽게 얻을 수 있어야 하는데, 임상시험허가. 품목허가 등 단계에서 더 많은 혜택을 누릴 수 있다.
중국의 희귀질환 전문가는 희귀질환을 발병률이 0.002‰ 넘지 않거나 신생아의 발병률이 0.1‰을 넘지 않는 질병으로 보고 있다. 이에 따라 중국에는 약 14억 인구와 국제적으로 인정된 약 7000개의 희귀 질환을 계산하면 중국에는 약 1904만 명이 희귀질병을 앓고 있는 것으로 나온다. 현재 미국에서 품목허가가 승인되 희귀의약품은 약 640종이고 중국에서 허가받은 의약품은 약 150개이다. 희귀질환의 의약품이 부족한 경우가 종종 있다. 그러나 이는 신약 개발의 ‘신대륙’으로 보아야 할 것이고 해외 제약사가 일찍이 희귀의약품 시장의 큰 잠재력을 높게 평가하여 희귀의약품 개발에 뛰었다. 이에 따라 매년 약 20개의 희귀의약품이 품목허가를 받고 있다.
2017년 CFDA는 우선심사의 희귀의약품 표2와 같이 발표하였다. Actelion Pharmaceuticals Ltd가 신청한 자베스카캡슐은 적절한 효소보충요법(알레르기, 과민반응, 정맥혈관이 좋지 않은 경우) 선택할 수 없는 성인 경·중도Ⅰ형 대사질환에 사용한다.
상하이중의대학(上海中医药大学)이 신청한 藿苓生肌과립은 근위축측삭경화증(ALS) 치료에 사용한다. 근육의 위축, 경련, 무력증을 완화한다. 현재 ALS의 원인이 밝혀지지 효과가 좋은 치료약도 부족한 상태이다. 단트롤렌나트륨수화물캡슐의 적응증은 각종 원인으로 발생한 상운동신경원 손상에 따른 경련성 근 장력 향상을 적응증으로 한다. 뇌졸중, 뇌외상, 척수손상, 뇌성마비. 다발성뇌혈관경화 등이 그 예이다. 재조합 인간 혈액응고제8인자는 혈장혈액제8인자 결핍인 A형 혈우병의 치료에 사용한다.
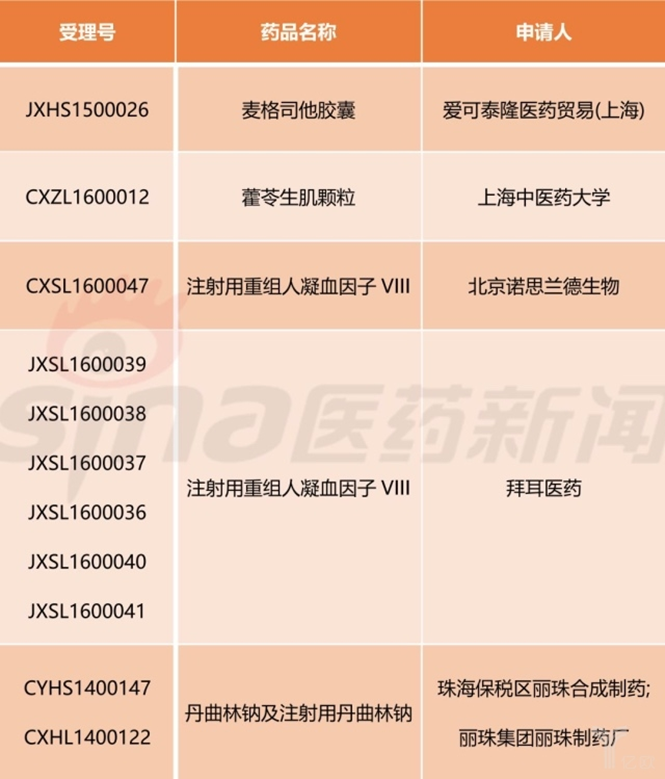
표2. CFDA의 우선심사 예정인 희귀질환 의약품
임상에서 시급한 제네릭 희귀의약품
희귀질환 환자에게 희귀의약품은 ‘생명수’와 같다. 그들은 오늘날 의료환경에서 평생 약을 먹어야 한다. ‘임상에서 시급한 제네릭’의 사용을 장려하기 위해 CFDA도 정기적으로 특허 만료, 중지, 무효 정보와 제네릭 신청을 하지 않은 의약품 리스트를 발표한다. 처음으로 발표된 리스트는 다음 표3과 같으며 여기에 고셔병, 요소회로대사이상, 유전적 오로틴산산성뇨 등 희귀질환이 포함되었다.

표3. 특허 만료, 중지. 무효, 제네릭이 없는 의약품에 관한 첫 리스트
정리하면, 희귀의약품에서 ‘임상적 가치가 분명한 신약’, ‘임상에서 시급한 제네릭’ 등이 우선심사 범위에 포함된다. ‘해외데이터인정’, ‘임상 간소화 또는 면제’, ‘조건부 허가’ 등을 통해 희귀의약품의 중국 내 허가 비용을 크게 낮추고 출시 시기를 앞당길 수 있다. 희귀의약품을 가진 한국 제약사에게 이는 분명히 좋은 소식일 것이다.
건강보험등재목록- 희귀의약품의 연구개발 착안점
중국 국내의 칭다오(青岛),저장(浙江), 상하이(上海) 등 일부 지역은 희귀질환 치료에 일정한 보조금을 지급한다. 2017년 중국의 국민건강보험부처도 협상을 통해 각 희귀의약품을 건강보험 지급 범위에 포함하기도 했다.
2012년 칭다오시가 《도시 의료구제제도에 대한 의견(시범 시행) (关于建立城镇大病医疗救助制度的意见(试行))》을 발표했다. 이 의견은 처음으로 희귀질환을 건강포험시스템에 포함하여 희귀질환에 대한 의료보장을 실현하였다. 2015년 상반기까지 건강보험에 등록된 외래진찰 희귀질환은 20종에 달했다. 고셔병을 예로 들면 실제로 의약품 비용 중에서 건강보험이 92%를 지급하고 개인 부담은 8% 내외로 환자가 약 10만 4,700위안을 지급했다.
2015년 저장성은 희귀 질환에 대한 보장시스템을 수립하여 전국에서 처음으로 희귀질환 리스트의 내용을 선별하고 의약품 협상을 진행했다. 글리벡 등 15종의 약품이 건강보험 지급대상으로 선정되었다. 2016년 저장성은 고셔병, 위축측삭경화증(ALS의 한 종류), 페닐케톤뇨증 등 3가지 희귀질환이 기본의료, 건강보험, 의료구제의 삼중 보상 시스템 혜택을 받게 되었다.
2011년 상하이어린이입원도움기금(上海市少儿住院互助基金)이 설립되었다. 고셔병, 파브리병, 폼페병, 점액 다당류증이 지급 범위에 포함되었고, 상하이의 신화병원(新华医院), 어린이병원(儿童医院), 루이진병원(瑞金医院) 세 곳이 전문 외래 병원으로 지정되어 치료를 담당하고 잇다. 이와 함께 페닐케톤뇨증, 단풍시럽뇨병 등 12종은 예방과 치료를 할 수 있는 유전적 희귀질환이다. 상하이시는 이에 대한 전문 보장 기금을 만들고 건강보험, 민정(民政), 홍십자회(红十字会) 가 함께 자금을 모으고 관리하기로 했다.
2017년 판 건강보험 의약품 목록에 수재된 55종 희귀의약품은 혈액질환, 뼈와 연골 병변, 선천성대사이상, 뇌 또는 신경계통병변, 면역질환, 피부 병변, 소화기 병변, 내분비질환 등 17종 희귀질환을 커버한다. 그중 갑류(甲类) 목록의 희귀 의약품 19종은 11개의 희귀질환을 커버하고, 을류(乙类)의 36개 의약품은 13종의 희귀질환을 커버한다. 다음 표2는 이에 대한 내용이다.



중국 희귀의약품 시장의 개발 전략
향후 5년은 희귀의약품 시장이 빠르게 성장하는 시기일 것이다. 글로벌 시장은 연평균 약 11.1% 성장할 것으로 예상한다. 전체 전문의약품에서 차지하는 비중도 높아져 2022년에는 20%를 넘어설 것으로 보인다. GDP가 약 6%씩 성장한다고 가정했을 때 중국의 희귀의약품은 이보다 더 빠르게 성장할 것이다.
베이징의 약파트너(北京药伙伴)라는 시장조사 업체에 따르면 2017년 10월 미국에서 승인한 희귀의약품은 약 477종 중 중국은 82종을 도입했고 일본에서 출시된 293개 품목 중에서 67종이 중국에 들어왔다. 호주에서 출시된 287종 가운데 50종이 중국에 들어왔으며 EU에서 출시된 76품목에서 10개가 중국에서 출시되었다.
2015년부터 중국 정부는 희귀의약품의 발전을 도모하기 위한 일련의 호재성 정책을 내놓았다. 특히, 우선심사, 해외임상데이터인정, 조건부 허가 등과 같은 시장진입(MA) 정책을 내놓아 중국 외의 국가의 희귀의약품이 중국에 쉽게 진입하도록 했다. 또한, 희귀의약품에 대한 건강보험 정책과 각 성과 시의 각종 보조 정책은 희귀의약품에 대한 비용 부담을 크게 낮추었다.
한국에서 출시된 의약품 또는 개발 중인 파이프라인 모두 중국 의약품 시장에 빠르게 들어올 기회이자 더 많은 혜택을 받을 기회일 것이다.
中国孤儿药市场开发与投资机会分析
罕见病(rare disease)是指发病率极低、患病人数相对很少的疾病或病变,其诊疗难度较大、治疗手段稀缺。罕见病用药是指用于治疗、诊断、预防罕见疾病的药品,包括但不限于药物、疫苗、诊断试剂等,也被称为“孤儿药”(orphan drugs)。在目前已发现的约7 000 种罕见病中,只有 1% 的罕见病有针对病因的有效治疗药品,但是价格昂贵,多数患者难以承受。
以下,笔者将从优先审评审批的“绿色通道”政策、医保药品目录的支付和市场开发策略三个层面,对中国孤儿药市场进行梳理与分析,抛砖引玉,期待大家更多的讨论。
孤儿药走上优先审评审批的“绿色通道”
为了缩短特需药品上市时间,各国药监部门一般会推出优先审评审批的“绿色通道”。为了提升我国医药创新水平,近年来CFDA也推出了优先审评审批制度
2017年12月28日,国家食品药品监督管理总局发布《关于鼓励药品创新实行优先审评审批的意见》新版本,进一步明确了药品优先审评审批范围。
药品优先审评审批范围紧扣“具有明显临床价值的新药”、“临床急需仿制药”、“儿童用药”以及防治“艾滋病、肺结核、病毒性肝炎、罕见病、恶性肿瘤、老年人特有和多发疾病”等特定疾病的药物。
罕见病用药具有明显临床价值的新药
罕见病绝大多数都是基因遗传病,虽然病情严重,但致病机制还算明确。尽管罕见病根治困难,但是有针对性地介入治疗还是能收到不错的效果,比如戈谢病、苯丙酮尿症等代谢缺陷性疾病。也就是说,孤儿药更容易取得明显的临床价值,进而在临床试验注册、上市申请等环节都会享有更多的便利。
根据我国罕见病专家共识,建议将罕见病定义为患病率低于0.002‰或新生儿发病率低于0.1‰的疾病。按照此定义,以我国约14亿人口和目前国际公认的约7000种罕见病为计算基数,我国罕见病总患病人口约1904万。目前,美国批准上市的孤儿药近650个,我国上市的孤儿药大约150个。罕见病缺医少药显而易见,但这也成为了新药开发的“新大陆”,国外药企早已看到孤儿药市场的巨大潜力,纷纷布局孤儿药开发,每年上市新药中约20个为孤儿药。
2017年,CFDA拟优先审评的罕见病用药如表2所示。由爱可泰隆医药贸易(上海)申报的麦格司他胶囊用于因不能选择适合的酶替代疗法(如变态反应、过敏反应或静脉通路不好)的成人轻中度Ⅰ型戈谢病。
由上海中医药大学申报的藿苓生肌颗粒用于治疗肌萎缩侧索硬化症(ALS),ALS 又称“渐冻人”,肌肉会缓慢出现萎缩、痉挛、无力等症状。目前ALS病因不明,缺乏特效治疗药物。丹曲林钠胶囊,适应症为用于各种原因引起的上运动神经元损伤所遗留的痉挛性肌张力增高状态,如脑卒中、脑外伤、脊髓损伤、脑性瘫痪、多发性脑血管硬化等。注射用重组人凝血因子VIII用于血浆凝血因子Ⅷ缺乏的甲型血友病治疗。

表2、CFDA拟优先审评的罕见病用药
临床急需罕见病仿制药
对于罕见病患者来说,孤儿药是“保命药”。目前的医疗条件下,罕见病患者大都需要终身服药,
为鼓励“临床急需仿制药”,CFDA也会定期发布一些专利权到期、终止、无效尚且无仿制申请的药品清单。首批药品清单如表3所示,涉及戈谢病、尿素循环代谢障碍、遗传性乳清酸尿症等罕见病症。

表3、首批专利权到期、终止、无效尚且无仿制申请的药品清单
总的来说,孤儿药符合“具有明显临床价值的新药”、“临床急需仿制药”等优先审批审评范围,可以通过“境外临时数据认可”,“减免临床”和“有条件上市”等政策,可以大大降低罕见病药品在中国上市的成本并缩短上市时间。对韩国有罕见病产品的厂家是非常好的消息。
医保药品目录——孤儿药研发的切入点
国内一些地区对于罕见病治疗给予了相应的医疗补贴,如青岛、浙江和上海。2017 年,国家医保部门也以谈判的方式将个别孤儿药纳入医疗保险报销范畴。
2012年,青岛市人民政府办公厅发布了《关于建立城镇大病医疗救助制度的意见(试行)》。本意见首开先河,第一次明确将罕见病纳入大病医疗保障体系中,实现了罕见病医疗保障制度的从无到有。截至2015年上半年,纳入门诊大病保障的罕见病种达到20种。以戈谢氏病为例,实际药品费用医疗保障部分占 92%、个人自负部分占 8%左右,患者年均自负 10.47 万元。
2015 年浙江省建立罕见病保障机制,在全国率先实行罕见病目录遴选和药品谈判,将格列卫等 15 种药品纳入大病保险支付范围。2016 年浙江省将戈谢氏病、萎缩侧索硬化症(渐冻症的一种)、苯丙酮尿症等 3 种罕见病纳入基本医疗、大病保险和医疗救助的三重保障体系。
2011年成立了上海市少儿住院互助基金,把戈谢氏病、法布雷病、庞贝病和粘多糖贮积症纳入支付范围,在新华医院、儿童医院和瑞金医院这三个定点医院的专科门诊进行治疗。同时,针对苯丙酮尿症、枫糖尿症等12 种可防可治的遗传性罕见病,上海市成立了专门的保障基金,由医保、民政和红十字会共同筹资并管理。
2017年版医保药品目录中收录的的55种罕用药共覆盖17 种罕见病,涉及血液疾病、骨及软骨病变、先天性代谢异常 、脑部或神经系统病变、免疫疾病、皮肤病变、消化系统病变、内分泌疾病等多个治疗领域。其中甲类目录罕用药19 种,覆盖11种罕见病;乙类目录罕用药36 种,覆盖13种罕见病。如表2所示。


中国罕见病市场开发策略
孤儿药市场在未来5年将迎来飞速发展期,全球孤儿药市场年平均增长率预计在11.1%。孤儿药市场规模占整个处方药市场的份额稳步提升,预计2022年将突破20%。鉴于中国GDP的增长速度未来仍在6%以上,孤儿药中国市场率增长将更高。
北京药伙伴罕见病数据研究院统计发现:截至2017年10月,美国上市的孤儿药有477个品规,中国已引进82个;日本上市293个品规中,已引入中国67个;澳大利亚上市的287个品规中,50个已在中国上市;欧盟上市的76个品规中,中国上市10个。
从2015年以来,中国政府出台一系列利好的政策促进孤儿药在中国的发展,特别是市场准入政策,如:优先审批、境外临时数据认可、有条件上市等政策,使得在中国以外孤儿药更容易在中国上市,再而,最新对于孤儿药医保政策和各个省市的各种保险的支持,使得孤儿药支付的难度也大大地降低。
无论是在韩国已上市的罕见病和在在研产品,都有很好机会快速进入中国医药市场,并且得到更多的收益。
- 이전글 이전글이 없습니다.
- 다음글 다음글이 없습니다.








